根据如图所示装置回答:
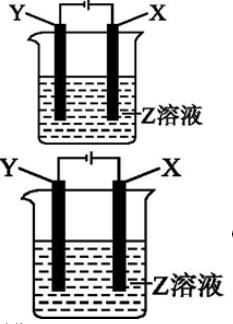
(1)当X为Pt, Y为Fe, Z为AgNO3时,阳极反应为 ,阴极反应为
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为 mol/L
根据如图所示装置回答:

(1)当X为Pt, Y为Fe, Z为AgNO3时,阳极反应为 ,阴极反应为
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为 mol/L