氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, N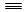 N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。


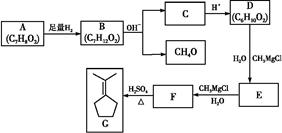
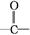
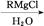
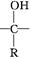

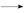


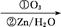
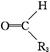
 +
+
 R—OH(R为脂肪烃或芳香烃的烃基)
R—OH(R为脂肪烃或芳香烃的烃基)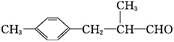
 粤公网安备 44130202000953号
粤公网安备 44130202000953号