工业上由二氧化锰制备高锰酸钾可分两步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2 2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,下列说法正确的是( )
2KMnO4+H2↑+2KOH,下列说法正确的是( )
| A.氧化性:KMnO4>K2MnO4>O2 |
| B.根据上述过程,每生成1 mol KMnO4共转移6 mol电子 |
| C.第二步电解时,KMnO4在阳极区生成 |
| D.第二步电解时,阴极周围pH减小 |
关于电解NaCl水溶液,下列叙述正确的是( )
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈现棕色 |
| C.若在阴极附近的溶液中滴入酚酞试液,溶液呈现无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈现中性 |
用惰性电极电解未精制的饱和食盐水,食盐水装在U形管内,结果很快在某一电极附近出现食盐水变浑浊现象。造成浑浊的难溶物主要是( )
| A.碳酸镁 | B.硫酸钡 | C.氢氧化镁 | D.碳酸钡 |
用惰性电极进行电解,下列说法正确的是( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |

| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼粗铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
| A.原电池正极和电解池阳极所发生的反应 |
| B.原电池正极和电解池阴极所发生的反应 |
| C.原电池负极和电解池阳极所发生的反应 |
| D.原电池负极和电解池阴极所发生的反应 |
将质量分数为0.052的NaOH溶液1L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010时停止电解,则这时溶液中应符合的关系是
| |
NaOH的质量分数 |
阴极析出的物质的质量/g |
阳极析出的物质的质量/g |
| A |
0.062 |
19 |
152 |
| B |
0.062 |
152 |
19 |
| C |
0.042 |
1.2 |
9.4 |
| D |
0.042 |
9.4 |
1.2 |
下列说法不正确的是( )
| A.原电池中电子由负极流向正极 |
| B.原电池中发生还原反应的电极是正极 |
| C.电解池中发生还原反应的电极是阳极 |
| D.电解池中质量增加的电极是阴极 |
若某装置中发生如下的反应:Cu+2H+=Cu2++H2↑,关于该装置的说法不正确的是( )
| A.该装置一定为原电池 | B.该装置一定为电解池 |
| C.金属铜为电解池的阳极 | D.电解质溶液可能是硝酸溶液 |
关于下图所示的装置叙述正确的是( )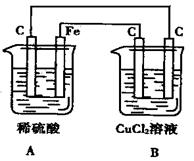
| A.装置A 是电解池,装置B是原电池 |
| B.装置A 是原电池,装置B是电解池 |
| C.电子由装置A中碳棒流向B 装置中碳棒 |
| D.工作一段时间后,A 装置中稀H2SO4溶液质量减轻,B装置中CuCl2溶液质量减轻 |
下列叙述不正确的是( )
| A.电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 |
| B.电解饱和食盐水时,用铁作阳极,C1-发生氧化反应 |
| C.电镀锌时,金属锌作阳极,电镀液可用硫酸锌溶液 |
| D.铜锌原电池中,锌作负极,电子沿导线从锌极流向铜极 |
用NaOH溶液吸收二
氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法正确的是( )
| A.阳极区酸性减弱 |
| B.阴极区电极反应式为:2H++2e—=H2↑ |
| C.该过程主要是为了获得H2SO4 |
| D.电解时两个电极都只能用惰性材料 |