下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L -1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2 ↑ ②中负极:2H + +2e-=H2 ↑ |
| D.溶液的pH变化:①减小,②增大 |
一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是
| A.N2在阴极上被氧化 |
| B.可选用铁作为阳极材料 |
| C.阳极的电极反应式是N2+6e-+6H+ = 2NH3 |
D.该过程的总反应式是N2+3H2 2NH3 2NH3 |
1 L某溶液中含有的离子如下表:
| 离子 |
Cu2+ |
Al3+ |
NO3- |
Cl- |
| 物质的量浓度(mol/L) |
1 |
1 |
a |
1 |
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液pH=0 B.a=3
C.阳极生成1.5mol Cl2 D.阴极析出的金属是铜与铝
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.电解后溶液中c(H+)为2 mol/L |
| B.上述电解过程中共转移2 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.原混合溶液中c(K+)为2 mol/L |
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得溶液中加入0.2mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
| A.1.0mol | B.1.2mol | C.0.6mol | D.0.8mol |
观察下列几个装置示意图,有关叙述不正确的是( )

| A.装置①中阴极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中a为负极,发生的电极反应式为H2+2OH﹣+2e﹣=2H2O |
| D.装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑ 电解过程中,以下判断正确的是( )
Al2O3+3H2↑ 电解过程中,以下判断正确的是( )

电浮选凝聚法是工业上采用的一种污水处理方法:在污水中通电生成Fe(OH)3胶体,Fe(OH)3胶体可吸附污染物而沉积下来,具有凝聚净化的作用:电极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去浮渣层,即起到了浮选净化的作用。某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法不正确的是
| A.装置A中铁片为阳极,发生的电极反应是Fe-2e- = Fe2+ |
| B.装置B中通入空气的电极反应是O2+2CO2+4e- = 2CO32— |
| C.污水中加入适量的硫酸钠,可增强溶液的导电性,提高污水的处理效果 |
| D.标准状况下,若A装置中产生了44.8L气体,则理论上B装置中要消耗CH4为1.12L |
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
有关下列电化学装置的说法中正确的是( )

| A.图a是原电池装置,可以实现化学能转化为电能 |
| B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
将H2S通入FeCl3 溶液中,过滤后将反应液加入电解槽中电解(如下图所示)。电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。下列有关说法正确的是
| A.过滤得到的沉淀可能是FeS和S |
| B.若有0.20mol的电子转移,一定能得到2.24L的氢气 |
| C.可以用Fe与外接电源的a极相连 |
| D.与a极相连的电极反应式为Fe2+-e-=Fe3+ |
在1LK2SO4和CuSO4的混合溶液中,c(SO42-)="2.0" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为
| A.2.0 mol·L-1 |
| B.1.5 mol·L-1 |
| C.1.0 mol·L-1 |
| D.0.5 mol·L-1 |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如右图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过。下列说法不正确的是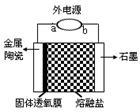
| A.a 极是电源的正极,O2-在熔融盐中从右往左迁移 |
| B.阳极电极反应式为2O2--4e- = O2↑ |
| C.阳极每产生4.48L的O2,理论上能生成0.2mol钛 |
| D.NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |