为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑ 电解过程中,以下判断正确的是( )
Al2O3+3H2↑ 电解过程中,以下判断正确的是( )
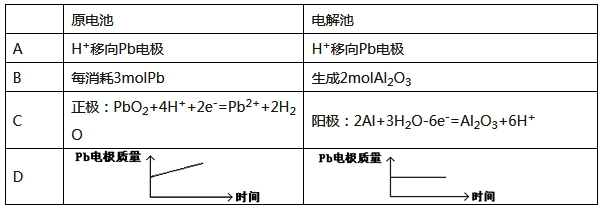
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑ 电解过程中,以下判断正确的是( )
Al2O3+3H2↑ 电解过程中,以下判断正确的是( )
