如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )

| A.甲、乙两烧杯中溶液的pH均保持不变; |
| B.甲烧杯a电极反应式为:4OH― - 4e- = O2↑+ 2H2O |
| C.电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜。一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是 ( )

| A.质量增加6.4g | B.质量增加12.8g |
| C.质量减少6.4g | D.质量减少12.8g |
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28 g时,B中电极上银增加的质量为( )

A.4.32 g B.2.16 g C.1.08 g D.0.54 g
保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
| A.Na2CO3溶液的碱性增强 |
| B.阳极反应:CO32--2e-+H2O = CO2↑+2OH- |
C.溶液中CO32-+H2O  HCO3-+OH-平衡不移动 HCO3-+OH-平衡不移动 |
| D.向溶液中加入一定量HCOOH的能复原 |
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是 ( )
后,下列叙述正确的是 ( )
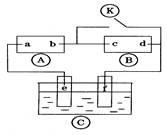
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.e极发生氧化反应 | D.f电极为锌板 |
已知A、B为单质,C为化合物。则下列说法正确的是( )
A+B C
C C溶液
C溶液 A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是
| A.阳极室溶液由无色变成棕黄色 |
| B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑ |
| C.电解一段时间后,阴极室溶液中的pH升高 |
| D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3 PO4 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)="6.0" mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况)。下列说法正确的是
| A.原混合溶液中c(K+)为3mol/L |
| B.上述电解过程中共转移4 mol电子 |
| C.电解得到的Cu的物质的量为0.5mol |
| D.电解后溶液上c(H+)为4 mol/L |
铝和氢氧化钾都是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示,下列说法正确的( )


| A.阳极产生KOH |
| B.阴极产生KOH |
| C.大量H+通过离子交换膜从左侧到右侧 |
| D.大量K+通过离子交换膜从右侧到左侧 |
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中不正确的是
| A.左槽中发生的反应是:2Cl--2e-=Cl2↑ |
| B.右槽中的反应式:2H++2 e-=H2↑ |
| C.H+从电解池左槽迁移到右槽 |
| D.FeCl3溶液可以循环利用 |
铅蓄电池的工作原理为Pb+PbO2+4H++2SO 2PbSO4+2H2O。下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液。先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )
2PbSO4+2H2O。下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液。先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )

A.闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.若再单独闭合S2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小
D.若再单独闭合S2,E、F电极上发生的反应与之前相同
传感器可以检测空气中SO2的含量,传感器工作原理如图所示,下列叙述正确的是
| A.a为电源的负极 |
| B.负极反应方程式为:Ag-e-+Cl-=AgCl |
| C.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O |
| D.当电路中转移电子的物质的量为5×10-5 mol时,进入传感器的SO2为1.12 mL |
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为( )
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |