某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e¯ ═ H2↑+ 2OH¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是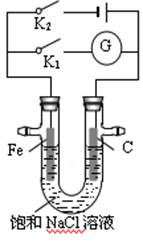
| A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐降低 |
| C.K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002 mol气体 |
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:

①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:

①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
若在铜片上镀银时,下列叙述正确的是
①将铜片接在电源的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag+ + e-= Ag,
④在银片上发生的反应是:4OH-= O2↑+ 2H2O+4e-,
⑤需用CuSO4溶液作电解液,
⑥需用AgNO3溶液作电解液
| A.①③⑥ | B.②③⑥ | C.①④⑤ | D.②③④⑥ |
世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H="-394k" J/mol
2C(石墨,s)+O2(g)═CO(g)△H="-222k" J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H="-242k" J/mol
则CO还原H2O(g)的热化学方程式为_________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。


(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________。
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式碳酸铜晶体(Cu2(OH)2CO3),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
| A.电解过程产生的气体体积(在标准状况下)为5.6 L |
| B.电解过程转移的电子数为3.612×1023个 |
C.电解过程只发生了2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
| D.加入碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O |
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=H2↑ |
| B.断开K1,闭合K2时,OH-向b极移动 |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| D.断开K2,闭合K1,一段时间后溶液的pH值要变大 |
下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
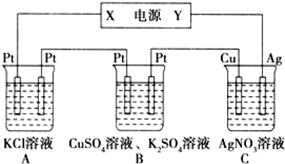
(1)电源电极X的名称为 。
(2)pH变化:A ,B ,C 。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的质的量浓度为 (设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为 (设电解前后溶液体积无变化)。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。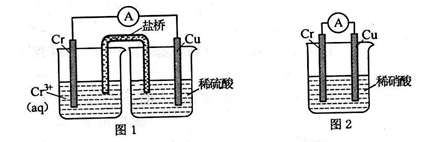
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。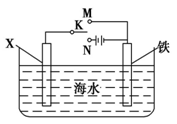
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
(1) 图中A为直流电源,B为浸透饱和氯化钠和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。
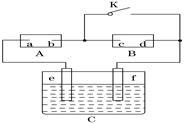
①电源A中a点为________极。
②滤纸B上发生的总反应的离子方程式为 。
③欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电镀槽中盛放的电镀液可以是________或________。
(2)加碘盐中的KIO3也可以用电化学氧化法制取:电解KI溶液可以制取KIO3。则电解时阳极材料可选用 (填“石墨”或“铜”)。写出该电极反应方程式
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量n(e—)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中正确的是( )
| A.电解前CuSO4溶液的物质的量浓度为2mol/L |
| B.电解后所得溶液中c(H+)=2mol/L |
| C.当n(e—)=0.6mol时,V(H2)∶V(O2)=3∶2 |
| D.向电解后的溶液中先后加入16gCuO和3.6g水,则溶液可恢复为电解前的浓度 |
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
氯碱工业是以电解饱和食盐水为原理的重要化工生产业。
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用 ;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的 (填化学式),至沉淀不再产生后,再加入过量的______________(填化学式)和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,解释其原因
[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]。
(4)食盐水中若含有NH4+,会在阳极产生难溶于水的NCl3,写出该电极反应式_________________