某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是
| A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 |
| D.甲中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
下列说法不正确的是
| A.氢气是一种环保、可再生的能源 |
| B.电解熔融AlCl3可制金属铝 |
| C.可溶性铁盐或铝盐常用于水的净化 |
| D.二氧化硅可用于制作光导纤维 |
用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是( )
| A.稀NaOH溶液 | B.HCl溶液 | C.CuSO4溶液 | D.AgNO3溶液 |
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.V L a mol·L﹣1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl﹣的数目大于3×6.02×1023 |
| C.标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 |
| D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数为0.5×6.02×1023 |
【改编】下列说法正确的是
| A.电解饱和食盐水可制取烧碱、氯气、氢气 |
| B.从海水提取物质都必须通过化学反应才能实现 |
| C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ |
| D.“绿色化学”的核心是利用化学原理进行环境治理 |
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

下列有关电化学装置完全正确的是( )
| A |
B |
C |
D |
 |
 |
 |
 |
| 铜的冶炼 |
铁上镀银 |
防止Fe被腐蚀 |
构成铜锌原电池 |
A.A B.B C.C D.D
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
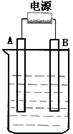
(1)A接的是电源的 极,B是该装置 极,B电极反应式为 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料。用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________
在电解水制H2和O2时,为了增强导电性,需加入一些电解质,下列物质可选用:
| A.CuSO4 | B.HC1 | C.NaCl | D.NaOH |
电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标准状况)约为( )
| A.0.28 L | B.0.56 L | C.0.14 L | D.11.2 L |
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
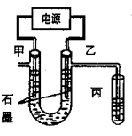
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作
| A.阴极 | B.阳极 | C.正极 | D.负极 |
如图所示,下列有关装置的分析中正确的是( )

| 选项 |
开关控制 |
X溶液 |
装置叙述 |
| A |
接通K2, 断开K1 |
HCl |
Fe极为正极, 该极质量减小 |
| B |
接通K2, 断开K1 |
CuCl2 |
Fe极为负极, 该极质量增加 |
| C |
接通K1, 断开K2 |
CuSO4 |
Fe极为阴极, 该极有Cu析出 |
| D |
接通K1, 断开K2 |
NaCl |
Fe极为阳极, 该极逐渐溶解 |
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )。
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀 ⑤电泳
| A.①② | B.②③⑤ | C.②③ | D.全部 |