科学地补充碘可防止碘缺乏病。
(1)上图为海带制碘的流程图。步骤③的实验操作中用到的玻璃仪器除了烧杯、玻璃棒之外还有 ;当步骤④反应中转移0.2mol电子时生成碘的质量:
(2)碘酸钾(KIO3)是食盐的加碘剂。KIO3在酸性介质中能与H2O2或I-作用均生成单质碘。
请回答下列问题:
①以碘为原料,通过电解制备碘酸钾的实验装置如图所示。电解前,将一定量的精制碘溶于过量氢氧化钾溶液,溶解是发生反应为:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区。电解时,阳极反应: I-+6OH--6e-=IO3-+3H2O,当外电路上通过3mol电子时(碘离子被完全消耗),溶液中的IO3-的物质的量是 ;阴极上产生的气体在标准状况下的体积: 。
②电解过程中,需通过检验阳极电解液中是否有I-存在以确定电解是否完成。请设计判断电解是否完成的实验方案,并填人下表。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 |
实验现象及结论 |
| |
|
重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)写出Cr2O3在高温焙烧时反应的化学方程式______________________
(2)写出硫酸酸化使Na-2CrO4转化为Na2Cr2O7的离子方程式 ______________。
(3)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到 Na2Cr2O7的转化,其原理如图所示。
①钠离子交换膜的一种材料是聚丙烯酸钠( ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;
②写出阳极的电极反应式__________
(4) Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩 余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为______________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是 _______.
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,______________________和是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式______________________________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行____________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______________中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是利用电渗析法由海水获得淡水的原理图。已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。
①阳离子交换膜是指_______________(填“A”或“B”);
②写出通电后阳极区的电极反应式____________。
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下: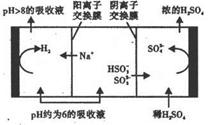
下列有关上述过程的说法错误的是
| A.NaOH溶液吸收SO2制得Na2SO3溶液的离子方程式:2OH-+SO2=SO32-+H2O |
| B.当吸收液呈中性时,溶液中的离子浓度满足:c(Na+)=2c(SO32-)+c(HSO3-) |
C.吸收液吸收SO2的过程中,pH与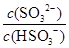 的大小成反比 的大小成反比 |
| D.HSO3-在阳极放电时的电极反应式:HSO3-+H2O-2e-=S042- +3H+ |
下图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是
| A.电源B端是正极 |
| B.a、c电极均有单质生成,其物质的量之比为2:1 |
| C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液 |
| D.f极附近变红,说明氢氧化铁胶粒带正电荷 |
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题: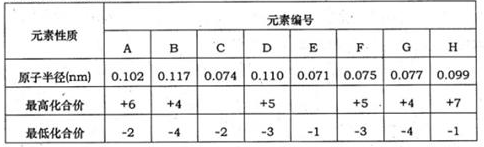
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系 ;
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为: 。
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式: 。
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式: 。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式_____________________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+) = 2.5×10-2 mol·L-1,除OH—之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为_____________________________。
②产品室中反应的离子方程式为_____________________。
根据下图,下列判断中不正确的是( )
| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-= H2↑+2OH- |
如图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C.烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
电解装置如图所示,电解槽内装有及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。

已知:
下列说法不正确的是
| A. |
右侧发生的电极方程式:
|
| B. |
电解结束时,右侧溶液中含有
|
| C. |
电解槽内发生反应的总化学方程式
|
| D. | 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
电解法处理酸性含铬废水(主要含有)时,以铁板作阴、阳极,处理过程中存在反应
,最后
以
形式除去,下列说法不正确的是()
| A. |
阳极反应为
|
| B. |
电解过程中溶液
|
| C. |
过程中有
|
| D. |
电路中每转移12 mol电子,最多有1 mol
|