氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池): 
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I-有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑.错误。 |
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题:
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
________________________________________________________________。
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)= 3Ag2O(s); △H=-236kJ·mol-1,
已知:2Ag2O(s)= 4Ag(s)+O2(g); △H=" +62" kJ·mol-1,
则O3转化为O2的热化学方程式为________________________________________________。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下表所示。
由上表可知pH增大能加速O3分解,表明对O3分解起催化作用的是__________(填微粒符号)。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。
臭氧在阳极周围的水中产生,其电极反应式为_______________________;阴极附近的氧气则生成过氧化氢,其电极反应式为_______________________。
下列判断正确的是( )
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
C.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液
恢复原状,则只需向电解液中通入一定量的HCl气体
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含
CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 。
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| ②反应结束后分离出溶液备用。 |
|
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体 ;
③一段时间后固体由红色变为绿色 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 、 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
则100ml滤液中Fe2+的浓度为 mol·L-1
部分难溶物的颜色和常温下的Ksp如下表所示:
| |
Cu(OH)2 |
CuOH |
CuCl |
Cu2O |
| 颜色 |
蓝色 |
黄色 |
白色 |
砖红色 |
| Ksp(25 ℃) |
1.6×10-19 |
1.0×10-14 |
1.2×10-6 |
— |

某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是 。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是 ,原因是___________________________________________________________________________________。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值(选填:不变、升高或下降),与电源正极相连的电极叫 极,检验该极上产物的方法是 。
(2)写出电解饱和食盐水的化学方程式 。
(3)如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是(选填A.B.c,多选扣分)
,该钡试剂可以是(选填A.B.c,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)判断钡试剂已经过量的方法是 。
(5)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为(选填a,b,c多选扣分)
,加入试剂的合理顺序为(选填a,b,c多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(6)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是 。
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_______________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。 |
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: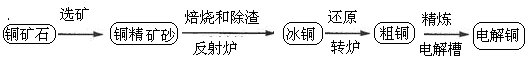
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
(1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)写出在电解过程中发生的电极方程式阳极: 。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极: 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。