如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是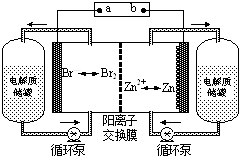
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是 ( )
| A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的化学式为HgNO3 |
| D.硝酸亚汞的化学式为Hg2(NO3)2 |
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2] =1.9×10-13。
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)过量的还原剂应是 。
(3)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(4)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(5)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);阳极产生的最后一种气体的反应式为 。
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如下图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
| 开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
| 沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
(10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_____(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为_________0.1
mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①右图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因________________。
(3)ClO2对污水中Fe2+、Mn2+、S2–和CN–等有明显的去除效果。某工厂污水中含CN– a mg/L,现用ClO2将CN–氧化,只生成两种气体,其离子反应方程式为 ;处理100 m3这种污水,至少需要ClO2 _______ mol。
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
I.用图1所示装置进行第一组实验。
(1)N极发生反应的电极反应式为 。
(2)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(4)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和4OH- - 4e-=2H2O + O2↑, 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn=Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(6)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:__________________________。
(共14分)有A、B、C、D、E、F、G七种元素核电荷数依次增加,A是非金属元素外围电子排布式为nsn,B的价电子层电子排布nsnnpn,C的基态原子中2p轨道有三个未成对的单电子,D是周期表中电负性数值最大的元素, E原子核外电子数是D与C核外电子数之和,F是主族元素且与G同周期,G能形成红色(或砖红色)的G2O和黑色的GO两种氧化物,D与F可形成离子化合物,其晶胞结构如下图所示。请回答下列问题。
(1)E的气态氧化物EO3分子结构模型是 。
(2)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (填字母)。
(3)从图中可以看出,D跟F形成的离子化合物的电子式为 ;该离子化合物晶体的密度
为ag· cm-3。,则晶胞的体积是 (只要求列出算式),每个D原子周围最近的F原子有 个。
(4)某科研小组为了处理污水,设计了如下图所示的的装置,Ⅱ装置为BA4燃料电池,两电极分别通入BA4和混合气体(空气和气体甲),电解质为熔融碳酸盐。Ⅰ是污水处理的装置,其方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。
①向污水中加入适量的H2SO4的目的是 ;
②为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为 Ⅱ装置中负极上发生的反应 ;
③Ⅰ装置中碳电极是电解池的 极,Fe电极上发生的反应为 ;
④Ⅱ装置中有0.8mol BA4参加反应时,C电极理论上生成气体的体积在标准状况下为 。
甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是( )
| A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①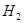 ②
②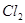 ③
③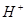 ④
④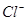 ⑤
⑤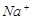 ⑥
⑥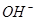
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。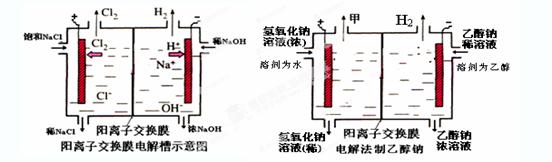
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,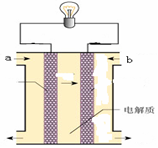
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH  2K2CO3+6H2O
2K2CO3+6H2O
(1)甲电池是 装置,A(石墨)电极的名称是 。
(2)写出电极反应式:
通入CH3OH的电极的电极反应式是 。
B(Ag)电极的电极反应式为 ,
(3)乙池中反应的总反应方程式为 。
(4)当乙池中A(Ag)极的质量增加5.40g时,甲池中理论上消耗O2
mL(标准状况下)。
工业废水中常含有一定量的Cr2O ,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O
,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
| A.电解时选用Fe作阳极,石墨棒作阴极 |
| B.阴极附近的沉淀只有Cr(OH)3 |
| C.阳极附近溶液中,发生反应的离子方程式是Cr2O72-+6Fe2++14H+===6Cr3++6Fe3++7H2O |
| D.消耗1 mol Cr2O72-将有336g Fe消耗,因此要定期更换铁电极 |
(14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;
③在不同温度下催化剂的催化效率与CO的生成速率如图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因 是 ;
(∆代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。