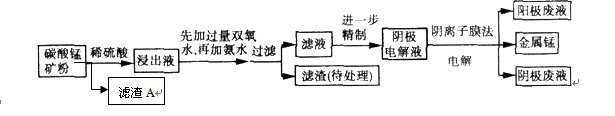
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
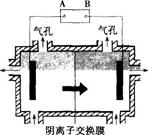
阴离子膜法电解装置如下图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg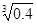 = -0.1 lg
= -0.1 lg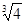 =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
| 开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
| 沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。

 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O



 粤公网安备 44130202000953号
粤公网安备 44130202000953号