(共14分)有A、B、C、D、E、F、G七种元素核电荷数依次增加,A是非金属元素外围电子排布式为nsn,B的价电子层电子排布nsnnpn,C的基态原子中2p轨道有三个未成对的单电子,D是周期表中电负性数值最大的元素, E原子核外电子数是D与C核外电子数之和,F是主族元素且与G同周期,G能形成红色(或砖红色)的G2O和黑色的GO两种氧化物,D与F可形成离子化合物,其晶胞结构如下图所示。请回答下列问题。
(1)E的气态氧化物EO3分子结构模型是 。
(2)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (填字母)。
(3)从图中可以看出,D跟F形成的离子化合物的电子式为 ;该离子化合物晶体的密度
为ag· cm-3。,则晶胞的体积是 (只要求列出算式),每个D原子周围最近的F原子有 个。
(4)某科研小组为了处理污水,设计了如下图所示的的装置,Ⅱ装置为BA4燃料电池,两电极分别通入BA4和混合气体(空气和气体甲),电解质为熔融碳酸盐。Ⅰ是污水处理的装置,其方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。
①向污水中加入适量的H2SO4的目的是 ;
②为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为 Ⅱ装置中负极上发生的反应 ;
③Ⅰ装置中碳电极是电解池的 极,Fe电极上发生的反应为 ;
④Ⅱ装置中有0.8mol BA4参加反应时,C电极理论上生成气体的体积在标准状况下为 。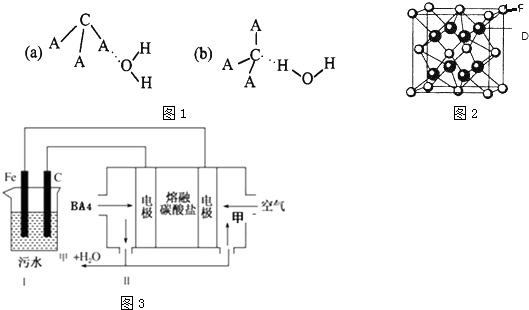
 绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心
绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心 ”又称为多巴胺系统。多巴胺结构为:
”又称为多巴胺系统。多巴胺结构为: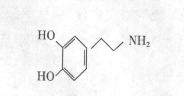
 非金属元素,它们的原子序数依次增大。X、Y、Z的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
非金属元素,它们的原子序数依次增大。X、Y、Z的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。 SO4、K2SO4七种物质:
SO4、K2SO4七种物质:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号