由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用下图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
(1)a极材料为 ,a电极反应式为 。
(2)电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极
上看到的气泡外,另一明显的现象为 。
(12分) 电化学原理在化学工业中有广泛应用。请根据下图回答有关问题
(1)装置I中能量的转化形式是 。导线上电子定向移动方向从 极到 极。其电极反应式 。
(2)装置II中若X、Y都是惰性电极,a是CuCl2溶液。则发生氧化反应的电极是 和 。检验X电极反应产物的方法是 。
若a是饱和NaCl溶液(氯碱工业生产原理),电极材料是石墨电极和铁电极。实验开始时,同时在两极各滴入几滴酚酞试液,则 (填“石墨或铁”)附近溶液先变红,其电极反应式 。
(3)当装置I和装置II的电路中均转移0.2mol电子时,则装置I中铁电极质量的变化
g(填写“增加”或“减少”及具体质量),装置II中收集到的气体共有 L(标准状况下)(以装置II中X、Y是惰性电极,a是CuCl2溶液计算)。
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池,写出电极反应式。
根据下图,回答下列问题:
(1)若闭合S1,装置属于______,锌极作______ 。
(2)若闭合S2,装置属于____,锌极上的反应为________。
(3)若闭合S3,装置属于______,总反应为________。
(每空1分共计10分)由铜、锌和稀盐酸组成的原电池中,
①铜是 极,发生 反应,电流的方向从 极到 极;锌是 极,发生 反应,电极反应式是 。
②当导线中有1 mol电子通过时,理论上锌片质量 (填增加或减少) g
③铜片 上析出
上析出
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题
(1)若两池中均为CuSO4溶液,反应一段时间后
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是________________________。
(2)若两池中均为饱和NaCl溶液
①写出乙池中总反应的离子方程式____________ __________。
②甲池中碳极上电极反应式是________________________, 乙池碳极上电极反应属于_____________________ (填氧化反应、还原反应)。
③将湿润的淀粉KI试纸放在乙池碳 极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为
极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为
5:1,且生成两种酸,该反应的化学方程式为_______________ _________ 。
④若乙池转移0.02mole-后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=____________
如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
(1)打开K2,合并K1。B为 极,A的电极反应为 ,最终可观察到的现象是
涉及的化学反应方程式有:
(2)打开K1,合并K2。E为 极,F极的电极反应 为 ,检验F极产生气体的方法是 。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 ,原因是
(5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,
(1) 电池的负极的电极反应式为__________
正极发生的是_______________反应(填反应类型);
(2) 总反应______________________________________________________________。
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
本题包括两小题,根据你所学的内容选择(1)或(2)其中一小题回答相关问题。
(1)在A图中,请加以必要连接(在图上画上),使铜片上冒H2气泡,则连接后的装置叫 ,该装置实现的能量转换是________________。

写出该装置的电极反应式:
锌片: ;铜片: ;
在B图中,加以必要的连接(在图上画上),使锌片上析出铜,则连接后的装置叫 ,
该装置实现的能量转换是________________。
写出该装置的电极反应式:
锌片: ;铜片: ;
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极 :
:
正极: (各2分)
(1).下列有关电化学的图示中,完全正确的是 
(2).碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。
请回答下列问题:
a、碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量泥沙杂质的固体碘。
b、电解前,先将一定量的精制碘溶于过量氢氧化钾溶
液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,
将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ,每生成1mol KIO3,电路中通过的电子的物质的量为___________________。
c、电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验
电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等。(用其中的一种或多种均可。)
| 实验方法 |
实验现象及结论 |
| |
|
d、电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是 ,步骤⑤的操作名称是 。步骤④洗涤
晶体的目的是 。
下图中电极a、b分别为Ag电极和P t电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
t电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答: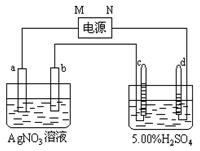
(1)直流电源 中,M为 极。
中,M为 极。
(2)写出c极上发生的电极反应式 。
(3)Pt电极上生成的物质是 ,其质量为 g。
(4)AgNO3溶液的浓度(填增大、减小或不变。) , H2SO4溶液的浓度 。( 同上)
同上)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。