图4-17为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
图4-17
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-====2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
下列叙述正确的是( )
| A.铜锌原电池工作一段时间后,铜的质量增加 |
| B.钢铁的吸氧腐蚀负极反应为:Fe-2e====Fe2+ |
| C.电解AlCl3溶液可得到Al |
| D.电镀时应把镀件置于电解池的阳极 |
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用下列物质中的( )
| A.NaOH | B.HCl |
| C.NaCl | D.CuSO4 |
关于如图4-10所示装置的叙述,正确的是( )

图4-10
| A.铜是阳极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
错误的是
| A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+ |
| B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,比较丙、丁活泼性
③用石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换丙单质判断甲、丙的活泼性
上述实验能达到目的的是 ( )
| A.①④ | B.②③ | C.③ | D.④ |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和O2,其中一极的电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O,有关此电池的错误的推断是
| A.通O2的电极为负极 |
| B.参加反应的O2与C2H6的物质的量比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.电解质溶液中,CO32-向正极移动 |
关于右图所示的原电池,下列说法正确的是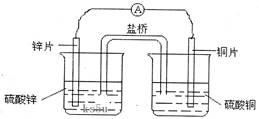
| A.电子从锌电极通过检流计流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.锌电极发生还原反应,铜电极发生氧化反应 |
| D.铜电极上发生的电极反应是2H++e-→H2↑ |
用铜片、银片、Cu(NO3) 2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型 管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( )
管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( )
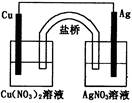

①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag+ + e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
一种新燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体(在熔融状态下能传导O2-)。下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是负极,电极反应为O2+4e- 2O2- 2O2- |
D.通入丁烷的一极是正极,电极反应为C4H10+13O2- 4CO2+5H2O+26e- 4CO2+5H2O+26e- |
有a、b、c、d四种金属,将a与b用导线联结起来,浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度盐酸中,d比a反应剧烈。将铜浸入b的盐溶液中,无明显变化。如果把铜浸入c的盐溶液中,有金属c析出。据此判断它们的活动性由强到弱的顺序是( )
| A.dcab | B.dabc | C.dbac | D.badc |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-→PbSO4+2e
正极:PbO2+4H+SO42-+2e→PbSO4+2H2O
今若制得Cl20.50mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025mol |
| B.0.050mol |
| C.0.10mol |
| D.0.20mol |
某蓄电池充放电时的反应如下:
有下列推断,其中正确的是:①放电时铁极为正极,Ni2O3为负极 ②充电时阴极上的电极反应式是Fe(OH)2+2e=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须浸在某种碱性电解质溶液中
| A.②③④ |
| B.①③④ |
| C.①②④ |
| D.①②③ |