固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )

| A.有O2放电的a极为电池的负极 |
| B.有H2放电的b极为电池的正极 |
C.a极对应的电极反应为O2+2H2O+4e- 4OH- 4OH- |
D.该电池的总反应方程式为2H2+O2 2H2O 2H2O |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++eˉ=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
2008北京奥运会圆满结束,其中“祥云”火炬燃料是丙烷(C3H8)气体。以丙烷、氧气和CO2及熔融碳酸盐可制作新型燃料电池,电池的总反应式为:C3H8+5O2====3CO2+4H2O。下列说法正确的是
| A.每消耗1 molC3H8可以向外电路提供12 mole- |
| B.负极通入C3H8,发生还原反应 |
| C.正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-=2CO32- |
| D.CO32-移向电池的正极 |
下列有关物质的性质和应用对应正确的是( )
| A.炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 |
| B.碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多 |
| C.盐酸与苛性钠可自发进行反应,该反应可以设计成原电池 |
| D.次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 |
氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
| A.(CN)2+2NaOH===NaCN+NaCNO+H2O |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O |
| C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合,若溶液最终PH=8,则c(CN-) c(HCN),原因是 。此溶液中c(CN-)与c(HCN)差值的数值为:
(5)已知HCN可以在氧气中燃烧成CO2、H2O和N2,由此原理可以设计酸性条件下原电池,书写其负极反应式: 。
有关下列装置的叙述不正确的是( )
① ②
② ③
③ ④
④
| A.图①铝片发生的电极反应式是:Al+4OH--3e-=AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+=Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O。电解质为KOH溶液,则负极反应式为______________________________。
(2)向BaCl2溶液中通CO2不会出现沉淀,因此某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间出现了白色沉淀,则产生该沉淀的离子反应方程式为_ 。
(3)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):___________________。
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= +4H2O +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是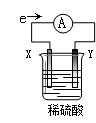
| A.外电路的电流方向为:X→外电路→Y |
| B.X极上发生的是还原反应 |
| C.溶液中氢离子向X极移动 |
| D.若两电极都是金属,则它们的活动性顺序为X>Y |
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
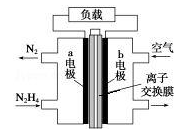
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
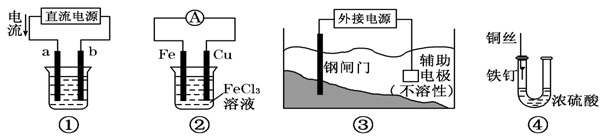
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |