太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
| A.放电时镍被还原 | B.放电时负极LaNi5H+OH——e—=LaNi5+H2O |
| C.充电时OH—向阴极移动 | D.充电时每消耗lmol Ni(OH)2转移lmol电子 |
观察下图,下列说法正确的是
| A.断开S1,闭合S2,C电极上发生的反应为O2+4e-+4H+=2H2O |
| B.断开S1,闭合S2,Fe电极作原电池的负极,发生还原反应。 |
| C.闭合S1,断开S2,溶液中的Cl- 向C电极方向移动。 |
| D.闭合S1,断开S2,阳极本身失电子,被氧化。 |
(12分)
(一)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为 。
I3-(aq),其平衡常数表达式为 。
(二)能量之间可以相互转化:原电池可将化学能转化为电能。
(1)下列反应能设计成原电池的是: 。
①2FeCl3+Fe=3FeCl2.C
②AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③NaOH+HC1=NaC1+H2O
(2)根据(1)所选的反应设计成原电池如图,请在图中完成并作相应标注。
写出该电池的正极反应式: ,电池工作的时候,盐桥中的阴离子移向 (填“负极”,“正极”或“不移动”)。
(3)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为: ;
若将该反应设计成下图的原电池,请在图中完成电极材料及电解质溶液的标注。
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
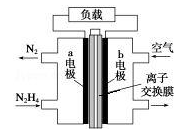
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
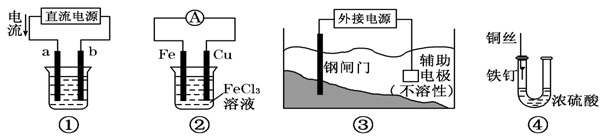
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |
下列各变化中属于原电池反应的是( )。
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,仍然能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
—种直接肼燃料电池的结构如图所示,下列说法正确的是
| A.a极为电池的正极 |
| B.电路中每转移6.02X1023个电子,则有1molNa+穿过膜向正极移动 |
C.b极的电极反应式为H202+2e- 20H- 20H- |
| D.用该电池电解饱和食盐水,当阳极生成2.24 L(标准状况)Cl2时,消耗肼0.1 mol |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
| A.充电时阳极反应:Ni(OH)2-e- + OH-=NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将饱和FeCl3溶液滴入沸水中 |
溶液变红褐色 |
有Fe(OH)3生成 |
| B |
向Na2S溶液中滴加盐酸 |
产生气泡 |
Cl的非金属性比S强 |
| C |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中含有SO42- |
| D |
用导线连接铜片和锌片后插进盐酸中 |
铜片上有气泡 |
铜片是原电池的正极 |
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。
电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )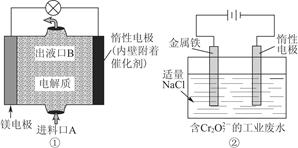
| A.图②中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图①中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ |
| D.若图①中3.6 g镁溶解产生的电量用于图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |