一种微生物燃料电池工作原理示意图如下,微生物膜中的酶作催化剂。下列叙述不正确的是
| A.电池工作时,既能净化废水,又能发电 |
| B.X电极为负极,工作时发生氧化反应 |
| C.正极反应式为2NO3-+10e-+6H2O =N2↑+12OH- |
| D.该电池在常温和高温时都可以工作 |
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) PbCO3(s)+SO42—(aq)。
PbCO3(s)+SO42—(aq)。
Ksp (PbCO3)=1.5×10-13,Ksp (PbSO4)=1.8×10-8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)计算上述反应的平衡常数:K= 。
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式____________
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3·Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3·Pb(OH)2和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究。
| 实验步骤 |
实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶。 |
无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3·Pb(OH)2 |
①你是否同意该同学的结论,并简述理由 。
②如果不同意,请提出改进意见___________________________
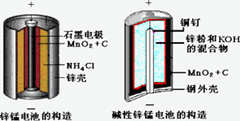
酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
(1) 酸性锌锰干电池的负极反应为_________
(2) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式__________
(3) 维持电流强度为0.6A,电池工作10分钟,理论消耗Zn g。(结果保留到小数点后两位,F=96500C/mol)
(4) 用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和_________溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为____到____之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀。
下图是一个化学过程的示意图。

I.(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:______________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:______________________________。(注意:背后还有试题)
(4)乙池中总反应的离子方程式:____________________________________________。
II.氯碱工业中电解饱和食盐水的原理示意图如图所示。

(1)溶液A的溶质是 ________________________________ ;
(2)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):

①盐泥a除泥沙外,还含有的物质是 ___________________________ 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 _______________________________。
③BaSO4的溶解度比BaCO3的小。过程Ⅱ中除去的离子有 _______________ 。
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是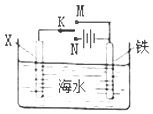
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
下图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的阳离子会移向CuSO4溶液 |
| C.正极附近的SO42-离子浓度逐渐增大 |
| D.锌离子在锌片表面被还原 |
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是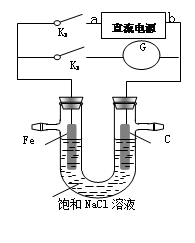
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开K1闭合K2时,电子沿“a →Fe→电解质溶液→C→b”的路径流动 |
| C.断开K1闭合K2时,铁电极附近溶液pH逐渐升高 |
| D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法 |
爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是
| A.放电时,Fe参与负极反应,NiO2参与正极反应 |
| B.充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- =" Fe" + 2OH- |
| C.蓄电池的电极必须浸入某种碱性电解质溶液中 |
| D.放电时,电解质溶液中的阴离子向正极方向移动 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
有甲、乙两个装置,下列说法错误的是
| A.甲、乙装置中,Zn的质量均减小 | B.甲、乙装置中,Cu上均有气泡产生 |
| C.化学反应速率 乙 > 甲 | D.甲中H+ 移向Zn,乙中H+ 移向Cu |
右图为一原电池的结构示意图,下列说法中,错误的是
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol e- 3H2+CO,每消耗1molCH4转移12mol e- |
| B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| C.电池工作时,CO32-向电极B移动 |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
关于下图所示的原电池,下列说法正确的是
| A.电子沿着盐桥从锌电极流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.电流从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |