铅蓄电池放电时的反应:PbO2+Pb+2H2SO4 =2PbSO4+2H2O,下列有关放电时的说法正确的是
| A.PbO2作正极,电极发生氧化反应 |
| B.当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g |
| C.负极的电极反应式是:Pb + SO42- - 2e- =PbSO4 |
| D.溶液中H+移向负极 |
在如图所示的原电池中,下列说法正确的是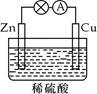
| A.负极发生还原反应 |
| B.正极反应为 Cu-2e-=Cu2+ |
| C.电子由铜片通过导线流向锌片 |
| D.反应一段时间后,溶液的酸性减弱 |
下列各变化中属于原电池反应的是( )。
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,仍然能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
铜锌原电池(如图)工作时,下列叙述正确的是 
| A.正极反应为:Zn-2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.当有1mol电子转移时,锌极减轻65g |
| D.盐桥中的K+移向ZnSO4溶液 |
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:l |
| B.还原产物为NH4+ |
| C.若有l mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
某小组用右图装置进行实验,下列说法正确的是( )

| A.盐桥中的电解质可以用KC1 |
| B.闭合K,外电路电流方向为Fe电极→石墨电极 |
| C.闭合K,石墨电极上只生成铜 |
| D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成 |
对如图所示装置的叙述不正确的是( )

| A.该装置可以将化学能转变为电能 | B.电子由锌电极向铜电极移动 |
| C.盐桥中的阴离子向锌电极移动 | D.锌电极为正极,发生氧化反应 |
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是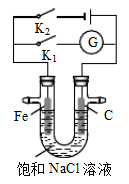
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐降低 |
| C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 |
| D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是 
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
将下图所示实验装置的K闭合,下列判断正确的是
| A.Cu电极上发生还原反应 |
| B.电子沿Zn→a→b→Cu路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是
| A.产生气体体积①=② |
| B.电极上析出固体质量①<② |
| C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑ ②中负极2H++2e-=H2↑ |
| D.溶液的pH变化:①减小②增大 |
把锌片和铁片放在盛有稀稀食盐水和K3[Fe(CN)6]试液混合溶液的培养皿中(如图所示平面图),经过一段时间后,下列说法中正确的是( )

| A.Ⅰ附近溶液pH降低 | B.Ⅱ附近很快出现蓝色沉淀 |
| C.Ⅲ附近产生黄绿色气体 | D.Ⅳ附近很快生成铁锈 |
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

| A.KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B.Cu作负极,发生还原反应 |
| C.电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 |
| D.工作一段时间后,AgNO3溶液中c(Ag+)减小 |
下列事实不用原电池原理解释的是( )
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 |
| D.烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |