【化学———化学与技术】
锶(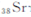 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与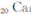
和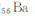 同属于第ⅡA族。
同属于第ⅡA族。
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 
①Ⅰ中,反应的化学方程式是 。
②Ⅱ中,能与盐酸反应溶解的物质有 。
③Ⅳ的目的是 。
④该工艺流程中NH4HCO3含有的化学键是 。
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)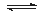 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T |
298 K |
398 K |
498 K |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。
(18分)0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______。
(2)取270 ℃所得样品,于570 ℃灼烧得到的
主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为___________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_____,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为____________________________________________________________;
(4)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是 mol·L-1。
汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主 要有Hg2+、Hg22+。
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液 溶解锌片回收汞,X溶液可以是 (填试剂名称)
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究“Hg-I-H2O”系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I-+4H+ =2HgI42-+S+2H2O,最后进行电解法电解吸收液(K2HgI4),阴极的电极反应式为
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L。某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放。已知:25℃HgS的Ksp= 4×10-52;Hg2S的Ksp=1.0×10-47,FeS 的Ksp=6.3×10-18;HgS+Na2S Na2HgS2(易溶)。
Na2HgS2(易溶)。
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放 (选填:“能”或“不能”)
②加入FeSO4溶液的作用(写出两项)
如图表示的是25 ℃时,难溶氢氧化物在不同pH下的溶解度(S/mol· L-1,假定该浓度为饱和溶液中阳离子的浓度)。
请完成下列问题:
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________(填选项) 。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________________________________________________。
(4)25 ℃下Ksp[Cu( OH )2 ]=________。
(5) 已知一些难溶物的溶度积常数如下表。
| 物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
| Ksp |
6.3× 10-18 |
2.5× 10-13 |
1.3× 10-35 |
3.4× 10-28 |
6.4× 10-33 |
1.6× 10-24 |
为除去工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________(填选项)。
A.NaOH B.FeS C.Na2S
(10 分)以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
① 为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为__________(填化学式)而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是___________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_______________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究已取得重大进展。用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C + ___K2Cr2O7 + _______=" ___" CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
请完成并配平上述化学方程式。
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是____________。
| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如右图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是__________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K =_______________________。
③已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气的热化学方程式为_________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其溶度积常数Ksp=c(Ca2+)·c(CO32—)=2.8×10−9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 -5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为________________________。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol· , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀 时的pH |
1.9 |
7.0 |
— |
— |
4.7 |
— |
| 沉淀完全 时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是_____(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(本题共8分,(1)~(3)问1分/空,(4)问4分) 以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应过滤结晶
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母每填对一个给1分但每错一个在本问内倒扣1分)。
A H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B 将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C 调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
滴定法是科研和生产中测定溶液中物质浓度的常用方法。
(1)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl—的浓度, [Ksp(AgCl) =1.56×10—10,Ksp(Ag2CrO4)=1.10×10—12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②已知该滴定适宜的酸度范围是pH 6.5~10.5,且当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl—及时释放出来,防止滴定终点提前
(2)氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72—,实验数据记录如下:
 实验数据 实验数据实验序号 |
FeSO4溶液体积读数/mL |
|
| 滴定前 |
滴定后 |
|
| 第一次 |
0.10 |
16.20 |
| 第二次 |
0.30 |
15.31 |
| 第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72—+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。