我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·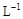 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号