某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c(Ca(OH)2)增大 ③pH不变
④c(H+)·c(OH-)的乘积不变 ⑤c(H+)一定增大
| A.① | B.①③ | C.①②④ | D.①⑤ |
t℃时,水的离子积为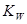 ,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
| A.混合液的pH=7 | B.混合液中c(H+)=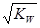 |
| C.a=b | D.混合液中c(B+)=c(A-)+c(OH-) |
将足量BaCO3粉末分别加入下列溶液中充分溶解至饱和。各溶液中Ba2+的浓度最小的为
| A.10 mL 0.2 mol/LNa2CO3溶液 | B.40 mL水 |
| C.50 mL 0.01 mol/L 氯化钡溶液 | D.100 mL 0.01 mol/L盐酸 |
常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10 、5.0×10
、5.0×10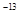 、8.3×10
、8.3×10 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )
| A.常温下在水中溶解能力AgCl>AgBr>Agl |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为:
| A.40mL 水 | B.10mL 0.2mol/LNa2CO3溶液 |
| C.50mL 0.01mol/L 氯化钡溶液 | D.100mL 0.01mol/L盐酸 |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |
下列关于电解质溶液的叙述正确的是( )
| A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2 |
| B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: |
c(NH4+)>c(SO42-)>c(H+) >c(OH-)
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
0.01 mol·L-1AgNO3溶液,下列叙述正确是( )
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中 约为1.02×103 约为1.02×103 |
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正向移动, 溶液中c(H+)增大 |
| B.加水,平衡向正向移动, c(CH3COOH)/ c(CH3COO-)增大 |
| C.通入少量 HCl,平衡逆向移动,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向逆向移动,溶液导电能力增强 |
100℃时,NaCl溶液中c(H+)=1×10-6 mol/L。下列说法中正确的是( )
| A.该NaCl溶液显酸性 |
| B.该NaCl溶液显碱性 |
| C.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-14 |
| D.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-12 |
已知。某溶液中含有
、
和
,浓度均为
,向该溶液中逐滴加入
的
溶液时,三种阴离子产生沉淀的先后顺序为()
| A. |
|
B. |
|
| C. |
|
D. |
|
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |