在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1.8×10-10,Ksp(AgY) = 1.0×10-12,Ksp(AgZ) = 8.7×10-17。下列说法(均在25℃)错误的是
| A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c(AgZ) |
| B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少 |
| C.若取0.188g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为1.0×10-2mol·L-1 |
| D.往C选项的溶液中加入1 mL 0.1mol·L-1的NaZ溶液,能生成AgZ沉淀 |
硼酸在玻璃制造和医药领域应用广泛。硼酸(H3BO3)溶液中存在如下电离过程:
H3BO3(aq)+H2O(l) 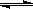 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
| A.25℃时0.7mol·L–1硼酸溶液中H+的浓度为2.0×10–5mol·L—1。 |
| B.硼酸与NaOH反应的离子方程式为H3BO3+OH–= [B(OH)4]–。 |
| C.碳酸钠溶液滴入硼酸中能观察到有气泡产生(已知碳酸的电离常数:K1=4.4×10—7、K2=4.7×10—11) |
| D.等物质的量浓度的Na[B(OH)4]溶液和CH3COONa溶液的pH:前者>后者(已知酸酸的电离常数K=1.75×10—5) |
溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是
| A.Al3+最先转化为Al(OH)3沉淀 |
| B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀 |
| C.要使Mg2+转化为沉淀,溶液pH应大于9 |
| D.pH=14时,四种金属离子全部以沉淀形式存在 |
水的电离过程为H2O H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
| A.c(H+)随着温度的升高而降低 | B.在35℃时,纯水中 c(H+) >c(OH-) |
| C.水的电离常数K(25℃)>K(35℃) | D.水的电离是一个吸热过程 |
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
硫酸钡用作钡餐的理由是:①既不溶于水,也不溶于酸 ②不易被X射线透过 ③对肠胃基本无害
| A.①②③ | B.只有① | C.只有② | D.只有②③ |
下列说法不正确的是( )
| A.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW |
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

| A.b点对应的Ksp等于c点对应的Ksp |
| B.采取蒸发溶剂的方法可以使溶液从a点变到b点 |
| C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)3 |
| D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
100℃时,NaCl溶液中c(H+)=1×10-6 mol/L。下列说法中正确的是( )
| A.该NaCl溶液显酸性 |
| B.该NaCl溶液显碱性 |
| C.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-14 |
| D.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-12 |
氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)  F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)  H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1)  H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
现将足量氢氧化镁投入下列溶液中,充分溶解后,溶液中c(Mg2+)最小的是
| A.0.1mol/L NaCl溶液 | B.0.1mol/L NH4Cl溶液 |
| C.0.1mol/L KOH溶液 | D.0.1mol/L KAlO2溶液 |
在一定条件下,Na2CO3溶液存在水解平衡: CO32-+H2O HCO3-+OH-,下列说法正确的是( )
HCO3-+OH-,下列说法正确的是( )
| A.稀释溶液,水解平衡常数增大 |
| B.加入NaOH固体,c(HCO3-)/c(CO32-) 减少 |
| C.升高温度,平衡常数减小 |
| D.通入CO2,pH增大 |
下列说法正确的是
| A.可用盐析法分离NaCl溶液和淀粉胶体 |
| B.0.1mol·L-1NaHCO3溶液中:c(Na+ )= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.常温下中和等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 |
| D.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,故新生成的 AgCl可转化为AgI |
化学与生产、生活密切相关,下列叙述错误的是
| A.用热的纯碱溶液清除灶具上的油污 |
| B.用硫酸清洗锅炉中的水垢 |
| C.用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质 |
| D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |