在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
| A.加MgCl2 | B.加H2O | C.加NaOH | D.加HCl |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)= |
D.KSP(CaF2)随温度和浓度的变化而变化 |
硫酸钡用作钡餐的理由是:①既不溶于水,也不溶于酸 ②不易被X射线透过 ③对肠胃基本无害
| A.①②③ | B.只有① | C.只有② | D.只有②③ |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2 |
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
下列关于电解质溶液的叙述正确的是( )
| A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2 |
| B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: |
c(NH4+)>c(SO42-)>c(H+) >c(OH-)
实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
| A.CuS易水解 |
| B.CuS可溶于盐酸 |
| C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大 |
| D.强酸可以制取弱酸 |
常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10 、5.0×10
、5.0×10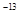 、8.3×10
、8.3×10 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )
| A.常温下在水中溶解能力AgCl>AgBr>Agl |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
向含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列说法中正确的是
| A.先生成沉淀,后沉淀全部溶解 |
| B.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
| C.当溶液中SO42-全部沉淀出来时,沉淀的总质量最大 |
| D.当溶液中Al 3+ 全部沉淀出来时,沉淀的总质量最大 |
在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
| A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.②③ | C.③④ | D.②④ |
已知25℃时,AgCl的溶度积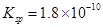 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有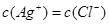 |
C.温度一定时,当溶液中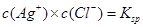 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑ 次要:Cu2+ + CO32─= CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2─ = CuS↓ 次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2< CuS < CuCO3 |