工业制硝酸经以下一系列反应: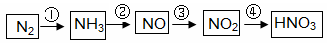
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: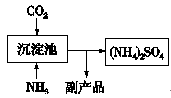
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。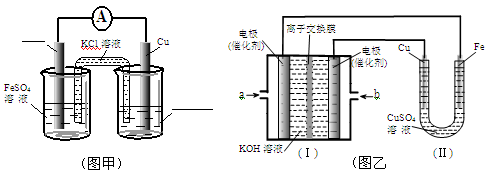
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过。
该电池的总反应式为:Li1-xFePO4+ LixC6="=" C6 + LiFePO4
(1)磷酸铁锂电池放电时,正极反应式为 。
(2)若用该电池电解精炼铜,阴极质量增重19.2g时,则电池中通过聚合物隔膜的Li +数目为 。
(3)以该电池为电源,用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),写出阳极的电极反应式 。
(4)学生在实验时若被白磷(以P表示)灼伤,可用硫酸铜溶液涂抹伤处,有铜和H3PO4生成,写出此反应的化学方程式 。
(5)一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=8.4×10-36mol2·L-2;H2S:Ka1=1.2×10-7mol·L-1,Ka2=7×10-15mol·L-1
①通过计算说明反应CuS(s)+2H+ Cu2++H2S进行的程度 。
Cu2++H2S进行的程度 。
②常温下,NaHS溶液呈碱性,此溶液中离子浓度由小到大的顺序是 。若向此溶液中加入硫酸铜溶液,恰好完全反应,所得溶液pH 7(填“>”“<”或“﹦”),其原因是 (用离子方程式表示)。
某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用下图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示 。
(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
已知各离子沉淀时的情况如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
| 完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是 ,
发生反应的离子方程式为 。乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
T2 |
| 水的离子积常数 |
1×10-14 |
1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
| 难溶物 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
| Ksp |
8.0×10-16 |
8.0×10-38 |
1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH) 2 |
9.6 |
11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
铁及其化合物有着广泛用途。
(1)将饱和三氯化铁溶液滴加至沸水中可制取氢氧化铁胶体,写出制取氢氧化铁胶体的化学方程式 。
(2)含有Cr2O72-的废水有毒,对人畜造成极大的危害,可加入一定量的硫酸亚铁和硫酸使Cr2O72-转化为Cr3+,该反应的离子方程式为 。然后再加入碱调节溶液的pH在6-8 之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
(3)铁镍蓄电池又称爱迪生蓄电池,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,充电时阳极附近的pH (填:降低、升高或不变),放电时负极的电极反应式为 。
(4)氧化铁是重要的工业原料,用废铁屑制备氧化铁流程如下: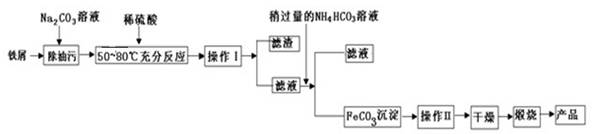
①铁屑溶于稀硫酸温度控制在50~800C的主要目的是 。
②写出在空气中煅烧FeCO3的化学方程式为 。
③FeCO3沉淀表面会吸附S042-,需要洗涤除去。
洗涤FeCO3沉淀的方法是 。
判断沉淀是否洗净的方法是 。
硅孔雀石是一种含铜的矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下: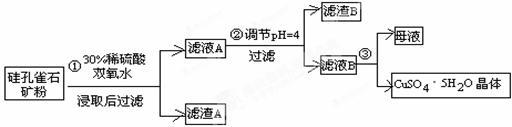
(1)步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式: ;
用离子方程式表示双氧水的作用_______________________________________。
(2)步骤②调节溶液pH选用试剂不可以是__________________
a.CuO b.Cu (OH)2 c.Cu2(OH)2CO3 d.CuSO4
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
由上表可知当溶液pH=4时,可以完全除去的离子是______(填金属离子符号,后同),不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶、洗涤可以得到CuSO4•5H2O晶体。某同学认为上述操作会有硫酸铝晶体析出。请你结合相关数据,通过计算对该同学的观点予以评价 (填“正确”、“不正确”、或“无法判断”)
【已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol/L,Ksp[Al(OH)3]=3.2×10-34】
(5)测定硫酸铜晶体(CuSO4•5H2O)里结晶水的含量,实验步骤为:a.研磨;b.称量空坩埚和装有试样的坩埚的质量;c.灼烧;d.干燥器中冷却;e.称量;f.重复c至e的操作,直到连续两次称量的质量差不超过0.1g为止;⑦根据实验数据计算硫酸铜结晶水的含量。
①步骤c用到的仪器有酒精灯、三脚架、泥三角、玻璃棒、 、 。
②步骤f的目的是 。
③如灼烧后在空气中冷却再称量,结晶水的测定结果会____(填“偏高”、“低”或“不变”)
(14分)铬(Cr)是周期表中VIB族元素,化合价可以是 0 ~+6 的整数价态。回答下列问题:
(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为 。
,则Cr的化合价为 。
(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+) ,而后又变成绿色 (Cr3+)。该电池总反应的过程表示为: ,2Cr2++2H+= 2Cr3++ H2。左侧烧杯溶液中c(Cl-) (填“增大”,“减小”或“不变”)。
(3)已知Ksp(BaCrO4)=1.2×10-10, Ksp(PbCrO4)= 2.8×10-13, Ksp(Ag2CrO4)= 2.0×10-12。某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01 mol/L ,向该溶液中逐滴入 0.01 mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为 。
(4)在溶液中存在如下平衡:
则反应 的平衡常数K= 。
的平衡常数K= 。
(5)CrO2-4呈四面体构型,结构为 。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为
。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为 。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
(6)CrO3是H2CrO4的酸酐,受热易分解。把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%。写出 CrO3受热分解化学方程式: 。
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
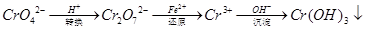
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
| A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高 |
| B.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
| C.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| D.常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2﹣最低浓度的对数值lgc(S2﹣)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
| A.25℃时K(CuS)约为1×10﹣35 |
| B.向100mLZn2+、Cu2+浓度均为10﹣5mol•L﹣1的混合溶液 中逐滴加入10﹣4mol•L﹣1的Na2S溶液,Cu2+先沉淀 |
| C.Na2S溶液中:c(S2﹣)+c(HS﹣)+c(H2S)═2c(Na+) |
| D.向Cu2+浓度为10﹣5mol•L﹣1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
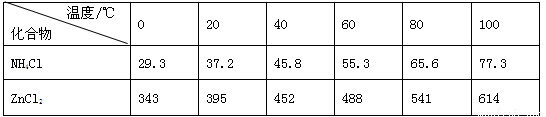
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 __ 分离回收;滤渣的主要成分是MnO2、_ __ __和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_ ____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为 _时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为 。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥ mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性。NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,,
和
等组成的糊状填充物,该电池在放电过程产生
,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(/100
水)

| 化合物 |
|||
| 10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5,电池工作五分钟,理论上消耗
。(已经
=96500
)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有和
,二者可通过分离回收;滤渣的主要成分是
、和,欲从中得到较纯的
,最简便的方法是,其原理是。
(4)用废电池的锌皮制备的过程中,需去除少量杂质铁,其方法是:加稀硫酸和
溶解,铁变为,加碱调节至
为时,铁刚好完全沉淀(离子浓度小于1×10-5
时,即可认为该离子沉淀完全);继续加碱调节至
为时,锌开始沉淀(假定
浓度为0.1
)。若上述过程不加
后果是,原因是。
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
| A.明矾 | B.二氧化氯 |
| C.臭氧 | D.高铁酸钠(Na2FeO4) |
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式: 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| |
含锌废水水质 |
经处理后的水国家环保标准值 |
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×1017), (填“符合”或“不符合”)国家环保标准。