2015年全国统一高考理综试卷(新课标Ⅱ卷)化学部分
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
原子序数依次增大的元素、、、,它们的最外层电子数分别为1、6、7、1。的电子层结构与氦相同,和的次外层有8个电子,和的电子层结构相同。下列叙述错误的是
| A. | 元素的非金属性次序为c>b>a |
| B. | 和其他3种元素均能形成共价化合物 |
| C. | 和其他3种元素均能形成离子化合物 |
| D. | 元素 、 、 各自最高和最低化合价的代数和分别为0、4、6 |
代表阿伏加德罗常数的值。下列叙述正确的是
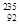 U发生裂变反应:
U发生裂变反应:
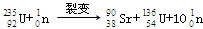 ,净产生的中子(
,净产生的中子(
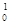 n)数为10
n)数为10
分子式为并能与饱和溶液反应放出气体的有机物有(不含立体异构)
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
海水开发利用的部分过程如图所示。下列说法错误的是
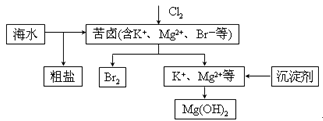
| A. | 向苦卤中通入 是为了提取溴 |
| B. | 粗盐可采用除杂和重结晶等过程提纯 |
| C. | 工业生产中常选用 作为沉淀剂 |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用 将其还原吸收 |
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
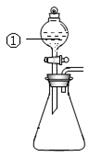
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D. |
草酸溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,,和等组成的糊状填充物,该电池在放电过程产生,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(/100水)

| 化合物 |
|||
| 近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5,电池工作五分钟,理论上消耗。(已经=96500)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有和,二者可通过分离回收;滤渣的主要成分是、和,欲从中得到较纯的,最简便的方法是,其原理是。
(4)用废电池的锌皮制备的过程中,需去除少量杂质铁,其方法是:加稀硫酸和溶解,铁变为,加碱调节至为时,铁刚好完全沉淀(离子浓度小于1×10-5时,即可认为该离子沉淀完全);继续加碱调节至为时,锌开始沉淀(假定浓度为0.1)。若上述过程不加后果是,原因是。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为、和)在催化剂的作用下合成甲醇,发生的主反应如下:
①
②
③
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
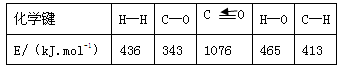
由此计算=,已知=-58,则=。
(2)反应①的化学平衡常数的表达式为;图1中能正确反映平衡常数随温度变化关系的曲线为(填曲线标记字母),其判断理由是。
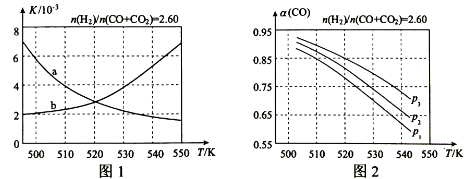
(3)合成气的组成=2.60时,体系中的平衡转化率()与温度和压强的关系如图2所示。值随温度升高而(填"增大"或"减小"),其原因是。图2中的压强由大到小为,其判断理由是。
二氧化氯(,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)工业上可用与在存在下制得,该反应氧化剂与还原剂物质的量之比为。
(2)实验室用、盐酸、(亚氯酸钠)为原料,通过以下过程制备:
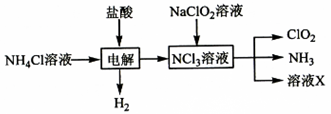
①电解时发生反应的化学方程式为。
②溶液中大量存在的阴离子有。
③除去中的可选用的试剂是(填标号)。
a.水 b.碱石灰 C.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中的含量:
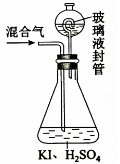
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 水溶解后,再加入3 稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(),指示剂显示终点时共用去20.00 硫代硫酸钠溶液。在此过程中:
①锥形瓶内与碘化钾反应的离子方程式为。
②玻璃液封装置的作用是。
③中加入的指示剂通常为,滴定至终点的现象是。
④测得混合气中的质量为。
(4)用处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:


相关化合物的物理常数
| 物质 |
相对分子质量 |
密度() |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器中通入的是。
(2)反应①和②分别在装置和中进行(填装置符号)。
(3)在分解釜中加入的为少置浓硫酸,其作用是,优点是用量少,缺点是。
(4)反应②为(填"放热"或"吸热")反应。反应温度控制在50-60℃,温度过高的安全隐患是。
(5)中和釜D中加入的Z最适宜的是(填编号。已知苯酚是一种弱酸)。
a. b. c. d.
(6)蒸馏塔中的馏出物和分别为和,判断的依据是。
(7)用该方法合成苯酚和丙酮的优点是。
、、、为原子序数依次增大的四种元索,和具有相同的电子构型;、 为同周期元索,核外电子总数是最外层电子数的3倍;元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中原子的核外电子排布式为。
(2)单质有两种同素异形体,其中沸点高的是(填分子式),原因是;和的氢化物所属的晶体类型分别为和。
(3)和反应可生成组成比为1:3的化合物, 的立体构型为,中心原子的杂化轨道类型为。
(4)化合物的立体构型为,中心原子的价层电子对数为,单质D与湿润的反应可制备,其化学方程式为。
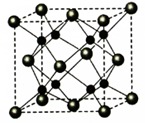
(5)和能够形成化合物,其晶胞结构如图所示,晶胞参数,=0.566, 的化学式为:晶胞中 原子的配位数为;列式计算晶体F的密度()。
聚戊二酸丙二醇酯()是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 的一种合成路线如下:
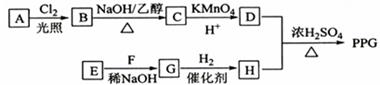
已知:
①烃的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物为单氯代烃:化合物的分子式为;
③为相对分子质量差14的同系物,是福尔马林的溶质;
④ 。
。
回答下列问题:
(1)的结构简式为。
(2)由生成的化学方程式为。
(3)由和生成的反应类型为,的化学名称为。
(4)①由和H生成的化学方程式为。
②若平均相对分子质量为10000,则其平均聚合度约为(填标号)。
a.48 b.58 c.76 d.122
(5)的同分异构体中能同时满足下列条件的共有种(不含立体异构):
①能与饱和溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写结构简式):
的所有同分异构体在下列-种表征仪器中显示的信号(或数据)完全相同,该仪器是(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
 粤公网安备 44130202000953号
粤公网安备 44130202000953号