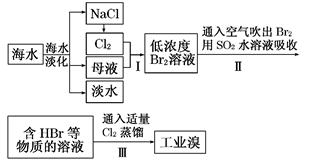
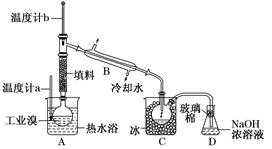
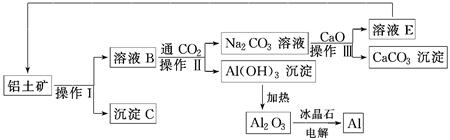
、、、为原子序数依次增大的四种元索,和具有相同的电子构型;、 为同周期元索,核外电子总数是最外层电子数的3倍;元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中原子的核外电子排布式为。
(2)单质有两种同素异形体,其中沸点高的是(填分子式),原因是;和的氢化物所属的晶体类型分别为和。
(3)和反应可生成组成比为1:3的化合物, 的立体构型为,中心原子的杂化轨道类型为。
(4)化合物的立体构型为,中心原子的价层电子对数为,单质D与湿润的反应可制备,其化学方程式为。
(5)和能够形成化合物,其晶胞结构如图所示,晶胞参数,=0.566, 的化学式为:晶胞中 原子的配位数为;列式计算晶体F的密度()。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号