酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,,和等组成的糊状填充物,该电池在放电过程产生,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(/100水)
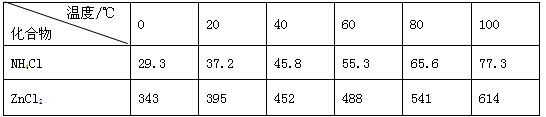
| 化合物 |
|||
| 近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5,电池工作五分钟,理论上消耗。(已经=96500)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有和,二者可通过分离回收;滤渣的主要成分是、和,欲从中得到较纯的,最简便的方法是,其原理是。
(4)用废电池的锌皮制备的过程中,需去除少量杂质铁,其方法是:加稀硫酸和溶解,铁变为,加碱调节至为时,铁刚好完全沉淀(离子浓度小于1×10-5时,即可认为该离子沉淀完全);继续加碱调节至为时,锌开始沉淀(假定浓度为0.1)。若上述过程不加后果是,原因是。

 TiO2.n H2O+2H+
TiO2.n H2O+2H+

 HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是______。
HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是______。


 NH4HCO3,NH4HCO3+NaCl(饱和)
NH4HCO3,NH4HCO3+NaCl(饱和)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号