(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ: ;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量 固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量 固体,观察反应速率是否变化。
通过观察到实验a和实验b现象,从而得出结论。
某研性学习小组用下图装置验证二氧化锰对氯酸钾分解的催化作用,实验时均以生成25mL气体为准,相关数据见下表: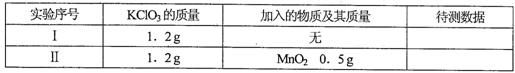
(1)仪器组装完成后,检验该套装置气密性的操作_________________________________________.
(2)上述实验中的待测数据应是________________________________________________.
(3)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中应注意_______________________________________________________.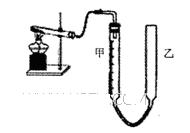
(4)实验小组经过讨论,认为上述实验还不能完全证明MnO2一定起了催化作用,需再补做实验。请利用实验反应后的剩余物和下面提供的合适用品补做实验(简要说明实验步骤,可不填满,也可以补充)。提供的用品有:H2O2溶液、浓盐酸、硝酸、MnO2、NaOH溶液、AgNO3溶液、KClO3、木条、淀粉-KI试纸、蒸馏水及必要的实验仪器。
①_____________________________________________________________________________
②_____________________________________________________________________________
③_____________________________________________________________________________
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当____ ,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 |
滴定前读数(mL) |
滴定后读数(mL) |
| 1 |
0.00 |
20.10 |
| 2 |
1.00 |
20.90 |
| 3 |
0.00 |
22.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是__________。
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶有少量水
C 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I- (快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜 色将如何变化 ?为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—) 。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: 

表中Vx= mL,反应速率最快的是 (填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)与 反应时间t的变化曲线图,若保持其他条件不变, (填“B”或“C”)曲线为降低反应温度, (填“B”或“C”)曲线为加入催化剂。
某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 |
H2C2O4溶液 |
KMnO4溶液 |
硫酸溶液 |
温度/℃ |
||
| |
浓度 (mol/L) |
体积 (mL) |
浓度 (mol/L) |
体积 (mL) |
|
|
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
50 |
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积 m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
|
|
|
|
120 |
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
|
|
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
分硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
(1)实验目的:
装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)装置乙中的加热方法称为 加热,该加热方法具有 、
等优点。
(3)通过甲、乙装置,分别进行了四组实验,数据记录如下,并经分析得出相关结论:
| 实验组号 |
温度 |
Na2S2O3 |
H2SO4 |
加入H2O 的体积 |
出现沉淀 所需时间 |
||
| 体积 |
浓度 |
体积 |
浓度 |
||||
| Ⅰ |
0OC |
5mL |
0.1mol/L |
10mL |
0.1mol/L |
5mL |
8s |
| Ⅱ |
0OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
12s |
| Ⅲ |
30OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
4s |
| Ⅳ |
30OC |
5mL |
0.2mol/L |
5mL |
0.2mol/L |
10mL |
2s |
结论1: ;
结论2: 。
化学是以实验为基础的学科。利用已学知识对下列实验进行分析并填空:
Ⅰ. 某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
(1)甲同学设计实验所涉及的离子方程式为 、
;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为 。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到 ;
(3)根据甲乙同学的实验可得到的结论是: 。
II.(6分) 
某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
| 编号 |
温度/℃ |
加入某盐 |
H2SO4体积/mL |
H2O体积/mL |
铝粉加入量/g |
铝粉溶解量 /g |
| ① |
20 |
不加 |
40 |
0 |
2.0050 |
0.0307 |
| ② |
80 |
不加 |
40 |
0 |
2.0050 |
0.1184 |
| ③ |
t1 |
不加 |
20 |
V1 |
2.0050 |
﹨ |
| ④ |
t2 |
5 mL0.01 mol·L-1 CuSO4溶液 |
20 |
V2 |
2.0050 |
﹨ |
(1)实验①和②的目的是 。
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。

(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。
控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙状态 |
c(HCl)/mol·L-1 |
溶液温度/oC |
碳酸钙消失时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
粒状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
粒状 |
0.6 |
20 |
41 |
280 |
| 4 |
粒状 |
0.8 |
20 |
40 |
200 |
| 5 |
粉末 |
0.8 |
20 |
40 |
30 |
| 6 |
粒状 |
1.0 |
20 |
40 |
120 |
| 7 |
粒状 |
1.0 |
30 |
50 |
40 |
| 8 |
粒状 |
1.2 |
20 |
40 |
90 |
| 9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。
(2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。
(4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 |
试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生 |
请回答下列问题:
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是___________________________________________________;实验中滴加FeCl3溶液的目的是________________________________________。
(3)实验②未观察到预期的实验现象。为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________(用实验中所提供的试剂或条件)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,分析判断OE、EF、FG三段中,___________段化学反应速率最快。
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol・L-1、0.001 mol・L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol・L-1)的用量均为2mL。
(1)配平化学方程式:
____KMnO4 +___H2C2O4 +____H2SO4 → ___K2SO4 +_____MnSO4 +_____CO2 +____H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量/ g |
KMnO4酸性溶液的浓度/mol・L-1 |
实验目的 |
| ① |
298 |
0.5 |
0.01 |
(Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和______探究催化剂对该反应速率的影响 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
0 |
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是________________
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度 / mol・L-1 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| 0.01 |
14 |
13 |
11 |
| 0.001 |
6 |
7 |
7 |
计算用0.001 mol・L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液体积的变化)。
(5)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案_____________________________________
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① |
4 |
|
10 |
30 |
| ② |
5 |
60 |
10 |
|
| ③ |
|
60 |
|
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,
请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |