广西桂林市下学期高二年级期末考试化学试卷
符合下列情况的化学反应一定能自发进行的是
| A.△H<0、△S>0 | B.△H<0、△S<0 |
| C.△H>0、△S<0 | D.△H>0、△S>0 |
关于下图的说法正确的是
| A.构成原电池时Cu是负极 |
| B.构成电解池时Cu是阴极 |
| C.构成电解池时质量增重的极是阴极 |
D.电池工作时溶液中的 一定移向Cu极 一定移向Cu极 |
现有可逆反应:X(g)+Y(g) 2Z(g)+W(s)
2Z(g)+W(s) H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
| A.降低温度 | B.增大Y的浓度 | C.加入催化剂 | D.增大容器的体积 |
下列说法正确的是
| A.K能层中不包含p能级 | B.碳原子的电子排布式为1s22p4 |
| C.3p3表示3p能级有三个轨道 | D.同一原子中,2p、3p、4p能级的轨道数依次增加 |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据电镀原理,钢芯镀镍时,钢芯应该做
| A.正极 | B.负极 | C.阳极 | D.阴极 |
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
| A.1 mol/L的AlCl3溶液 | B.2mol/L的NaCl溶液 |
| C.1.4mol/L的BaCl2溶液 | D.1mol/L的MgCl2溶液 |
以下大小关系不正确的是
| A.熔点:Na>Mg | B.硬度:金刚石>晶体硅 |
| C.键能:H—F>H—Cl | D.晶格能:NaF>NaCl |
下列有关叙述中,不可以用氢键来解释的是
| A.0℃时,水的密度大于冰的密度 | B.水的熔沸点高于硫化氢的熔沸点 |
| C.氟化氢气体极易溶于水 | D.氟化氢比氯化氢稳定 |
室温下,某溶液中水电离出的H+浓度为 ,则该溶液中一定不可能大量存在的离子是
,则该溶液中一定不可能大量存在的离子是
| A.Cl— | B. |
C.Na+ | D. |
下列各组物质中,酸性由强到弱的排列顺序错误的是
| A.HClO H2CO3 CH3COOH | B.HClO4 HClO3 HClO2 |
| C.HClO4 H2SO4 H3PO4 | D.HClO4 HBrO4 HIO4 |
一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应:2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
| A.反应进行30 s时,正反应速率等于逆反应速率 |
| B.反应进行80 s时,逆反应速率大于正反应速率 |
| C.反应进行60 s时,X的物质的量浓度为0.04 mol/L |
| D.反应进行60 s时,Y的转化率为70% |
用相同浓度的标准盐酸滴定相同体积、相同pH的 、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V1=V2>V3 | D.V3>V2=V1 |
按要求填写空白:
(1)写出醋酸钠在水中发生水解反应的离子方程式:____________。
(2)浓度均为0.1mol/L的下列4种物质的水溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
pH由大到小的顺序是_________(填数字序号)。
(3)在①H2O ②HCHO ③Cl2 ④C2H2 ⑤CCl4分子中:
全部以非极性键结合的非极性分子是_________(填数字序号,下同);
全部以极性键相结合,具有V形分子立体构型的是________;
中心原子为sp3杂化的非极性分子是_________;
中心原子为sp2杂化的极性分子是________;
既有极性键又有非极性键的非极性分子是_____________。
化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 |
影响条件 |
| ①食物放在冰箱里能延长保质期 |
温度(示例) |
| ②实验室将块状药品研细,再进行反应 |
____________ |
| ③用H2O2分解制O2时,加入MnO2 |
____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 |
____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示:
①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
按下图装置进行实验,回答下列问题(C、C1、C2均为石墨电极)。
(1)铁电极为__________极,电极反应式为__________;
(2)石墨棒C1为__________极,石墨棒C2附近的实验现象为____________________。
(3)当C2极产生2.24 L气体(标准状态)时,A中CuSO4溶液的质量改变了__________g。
某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 |
H2C2O4溶液 |
KMnO4溶液 |
硫酸溶液 |
温度/℃ |
||
| |
浓度 (mol/L) |
体积 (mL) |
浓度 (mol/L) |
体积 (mL) |
|
|
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
50 |
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。



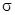 键和
键和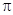 键的数目分别为
键的数目分别为







 粤公网安备 44130202000953号
粤公网安备 44130202000953号