某学生为了探究锌与盐酸反应过程中速率变化,在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)在0~1、1~2、2~3、3~4、4~5 min各时间段中:反应速率最大的时间段是 ,主要的原因可能是 ;反应速率最小的时间段是 ,原因是 。
(2)在2 ~ 3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水
B.Na2SO4溶液
C.NaOH溶液
D.H2SO4溶液
E.Na2CO3溶液
你认为可行的是(填编号) 。
对于反应2SO2+O2 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充人Ne |
|
影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象 。
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 。
(3)工业上常将固体燃料粉碎,以提高燃烧效率 。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
①该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响: 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式 _______________ ______。
②实验结果说明催化剂作用的大小与________ _________有关。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
你认为可行的是 。
(12分)一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
(1)该反应的化学方程式是 。
(2)在图上所示的三个时刻中, (填“t1”“t2”或“t3”)时刻处于平衡状态,此时v正 v逆(填“>”“<”或“=”);0- t2时间段内v(N) = 。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再改变” (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是 (选填字母)。
| A.升高温度 | B.降低压强 |
| C.减小M的浓度 | D.将反应容器体积缩小 |
某学生为了探究足量的锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL,标况下) |
50 |
120 |
232 |
290 |
310 |
(1)假设用V1、V2、V3、V4、V5依次表示0~1、1~2、2~3、3~4、4~5每分钟内的反应速率,则速率由大到小的排列顺序为 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率V3= 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间(秒)
①研究小组在设计方案时,考虑了浓度、 、 等因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
①写出H2O2发生的化学反应方程式 。
②实验结果说明催化剂作用的大小与 有关。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10 mL H2O2制取150 mL O2所需的时间(秒)
(1)该研究小组在设计方案时,考虑了浓度、____________、____________等因素对过氧化氢分解速率的影响;
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89 kJ能量,写出该反应的热化学方程式:____________________;
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g) 4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
| A.υ(NH3)="0.4" mol / (L·s) |
| B.υ(O2)="0.5" mol / (L·s) |
| C.υ(NO)="0.6" mol / (L·s) |
| D.υ(H2O)="1" mol / (L·min) |
在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:
(1)该反应的化学方程式为 。
(2)0~t1 s内A气体的反应速率为 。
(3)反应后与反应前的压强之比为 。
(4)(t1+10)s时,A气体的体积分数为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(5)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
(1)曲线由O →a段不产生氢气的原因(请用有关反应的化学方程式表示)是 。
(2)曲线a→c段,产生氢气的速率增加较快,而曲线由c以后,产生氢气的速率逐渐下降,解释上述现象的原因是 。
(3)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 (假设反应前后溶液体积不变)。
(4)对于足量镁条和100ml 2mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是 。
① 加NaOH固体;
② 加适量BaCl2溶液;
③ 加KNO3溶液;
④ 加适量H2O;
⑤ 将镁条换成镁粉;
⑥ 加小苏打溶液;
⑦ 加少量CuSO4溶液;
⑧ 加适量Na2SO4溶液;
⑨ 将2 mol/L硫酸换成160mL 2.5mol/L的盐酸 ;
(5)若使用催化剂,会不会使氢气的产量增加? (填“会”或“不会”)。
向200 mL 6 mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则速率从大到小的顺序为____________________________。(用v1、v2、v3表示)
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是_________(填字母)。
| A.蒸馏水 |
| B.氯化钾固体 |
| C.氯化钠溶液 |
| D.浓盐酸 |
E.降低温度
F.减少CaCO3
(3)若反应过程中溶液体积的变化忽略不计,计算FG段用盐酸表示的化学反应速率是多少?(写出计算过程):________________。
(6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5minZ的平均反应速率为 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下: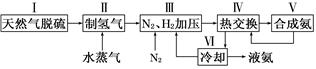
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量 。(填“变大”“变小”或“不变”)
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量 。(填“变大”“变小”或“不变”)
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是_____。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为_____________。上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)__________。简述本流程中提高合成氨原料总转化率的方法:_____________________________________。