(6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。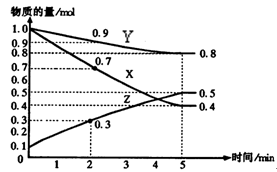
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5minZ的平均反应速率为 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。
相关知识点
(6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5minZ的平均反应速率为 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。