下列条件中不可以加快2H2O2(aq)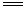 2H2O(l)+O2(g)的化学反应速率的是
2H2O(l)+O2(g)的化学反应速率的是
| A.增大H2O2的浓度 | B.加入MnO2作催化剂 |
| C.升高反应温度 | D.增大压强 |
在100mL2mol/L的盐酸中加入足量的纯锌片,为了加快反应速率,又不影响生成氢气的总量,可采取的方法是
| A.加入适量6mol/L的HCl | B.加入少量CuCl2固体 |
| C.对盐酸加热浓缩 | D.把纯锌片换成纯锌粒 |
已知N2 (g) + 3H2(g)  2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
①只有在此温度下反应才能发生 ②升高温度有利于NH3的合成
③提高反应速率,以提高单位时间内NH3的产量 ④使催化剂达到最佳催化活性
| A.③④ | B.①② | C.①③ | D.②④ |
反应3X(g)+Y(g)  Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为
| A.v(x)=0.02mol·L-1·min-1 | B.v(y)=0.02mol·L-1·min-1 |
| C.v(z)=0.10mol·L-1·min-1 | D.v(w)=0.02mol·L-1·min-1 |
下列叙述正确的是
A.某醋酸溶液的 ,将此溶液稀释1倍后,溶液的 ,将此溶液稀释1倍后,溶液的 ,则 ,则 |
B.在滴有酚酞溶液的氨水里,加入 至溶液恰好无色,则此时溶液的 至溶液恰好无色,则此时溶液的 |
C. 盐酸的 盐酸的 , , 盐酸的 盐酸的 |
D.若1mL 的盐酸与100mL 的盐酸与100mL 溶液混合后,溶液的 溶液混合后,溶液的 ,则 ,则 溶液的 溶液的 |
在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率瞬时增大的措施是
C(g)+D(g)正反应速率瞬时增大的措施是
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |
下列反应中,改变温度、反应物的用量或浓度,不会改变生成物的是
| A.硫化氢气体在氧气中燃烧 | B.氯气通入氢氧化钠溶液中 |
| C.细铁丝在硫蒸气中反应 | D.硫酸与锌粒的作用 |
室温下,向100mL 0.1mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入试剂( )
| A.NaNO3溶液 | B.碳酸钠溶液 | C.碳酸钠晶体 | D.NaCl溶液 |
在2 L的密闭容器中发生反应:2SO2 + O2 2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
| A.用SO2的浓度变化表示的反应速率为4 mol/(L·min) |
| B.用O2的浓度变化表示的反应速率为2 mol/(L·min) |
| C.增大压强,正反应速率增大,逆反应速率减小 |
| D.升高温度,正反应速率和逆反应速率都增大 |
工业上合成氨时一般采用500℃左右的温度,其原因是
(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率
(4)催化剂在5000C时活性最大
| A.只有(1) | B.(1)(2) | C.(2)(3)(4) | D.(1)(4) |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NaCl固体 ④CH3COONa固体 ⑤KCl溶液
| A.①② | B.②③⑤ | C.②④ | D.②④⑤ |
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,生成4mol z时放出热量Q KJ, 它们的物质的量随时间的变化如表所示。
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
(1)根据上表中数据,在答卷该题相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2) 写出体系中发生反应的热化学方程式 ______;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4) 该反应达到平衡时反应物X的转化率 等于______________________;
等于______________________;
(5) 改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1 _____2_____3_____的曲线:
在温度相同,压强分别为p1和p2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )
nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )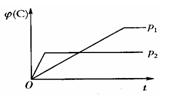
| A.p1>p2 ,n<3 | B.p1<p2 ,n>3 |
| C.p1>p2 ,n>3 | D.p1<p2 ,n<3 |