碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。
A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO )>c(OH
)>c(OH )> c(H+)
)> c(H+)
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与 有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,
下列能判断该反应达到化学平衡状态的是 (填字母,下同)
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 molH—O键
c.υ正(CO) =υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数
CO2(g)+H2(g),得到如下三组数
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以υ(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)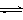 CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。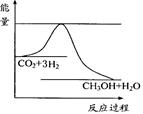
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉(不考虑反应前后溶液体积的变化)。反应开始至2min末收集到氢气1.12L(标准状况下),在此之后,又经过4min铁粉全部溶解,则:
⑴在前2min内用FeCl2表示的平均反应速率为多少?
⑵在后4min内用HCl表示的平均反应速率为多少?
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。

下列分析不正确的是:
A.0~4分钟时,A的平均反应速率为0.02mol/(L•min)
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.此反应的正反应为放热反应
发展低碳经济,构建低碳社会。科学家们提出利用以工业废气中的CO2为原料,以CuO与ZnO混合物为催化剂,其反应为:CO2+3H2 CH3OH + H2O。
CH3OH + H2O。
(1)某温度下,在体积为l L的密闭容器中充入lmol CO2和4molH2,测得CO2和CH3OH(g)的浓度随时间变化如Ⅰ图所示。从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;氢气的转化率为 。
(2)常温常压下已知下列反应的能量变化如Ⅱ图所示:写出由二氧化碳和氢气制备甲醇的热化学方程式: ,该反应的△S___0(填“>”或“<”或“=”);反应达到平衡后,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.升高温度 |
| C.恒容条件下通入CO2 | D.使用合适的催化剂 |
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO等副产物出现,且CO2的转化率、甲醇和CO的含量还受气体混合物在反应锅炉内的流动速率、催化剂CuO的质量分数影响。通过实验分别得到如下图。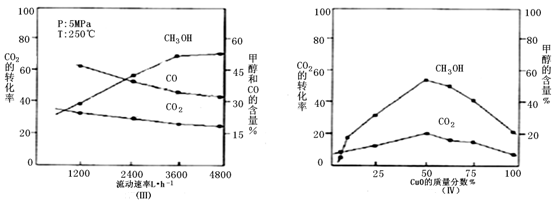
①由图Ⅲ得,生产甲醇的气体最佳流动速率为 L•h-1;
②已知当催化剂中没有CuO,只有单组份ZnO时,反应速率最大。说明为什么不选择单组份ZnO的原因 ,根据图Ⅳ判断,催化剂CuO的质量分数最好为 %。
(10分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产 甲醇燃料。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH =-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/(L·min);
(2)氢气的转化率=________;
(3)该反应的平衡常数为________(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
将4 molA气体和2 molB气体在2 L的容器中发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol / (L·s)
②用物质B表示的反应的平均速率为0.6 mol / (L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol / L
| A.①③ | B.①④ | C.②③ | D.③④ |
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法:2Cu+H2O  Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
②2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
③2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。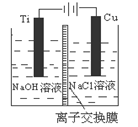
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验: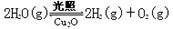 ⊿H>0
⊿H>0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏
高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理
由是: 。在该实验中需要测定某种数据,
完成一次实验,需要测定该数据的次数为 次。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:

图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。③该实验结果中,你估计与酸反应较快的是 。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。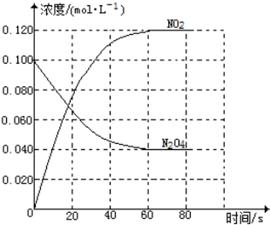
在0~60s时段,反应速率v(N2O4)为 mol•L-1•s-1;反应的平衡常数K1= mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T 100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2= mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向 (填“正”或“逆”)反应方向移动。
(原创)含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ |
30 |
40 |
50 |
| NH3生成量/10-6mol |
4.8 |
5.9 |
6.0 |
①写出常温下“人工固氮”反应的化学方程式:
此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式:
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
某酸性工业废水中含有K2Cr2O7。光照下,草酸能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
|
|
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;
实验①中0~t1时间段反应速率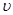 (Cr3+)= mol/(L·min) (用代数式表示)。
(Cr3+)= mol/(L·min) (用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·2H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| |
|
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 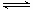 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 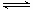 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 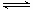 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
温度 浓度 时间 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题: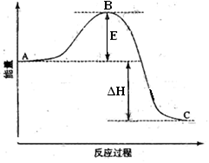
(1)图中A、C分别表示______________________、__________________________ ,E的大小对该反应的反应热有无影响?________________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________ 理由是_____________________________.
(2)图中△H= _______________ KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_________________________________________
(4)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= ______________mol·L—1·min—1、υ(SO3)="____________" mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H______________(要求计算过程)。