在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。
在0~60s时段,反应速率v(N2O4)为 mol•L-1•s-1;反应的平衡常数K1= mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T 100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2= mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向 (填“正”或“逆”)反应方向移动。


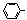 ):
):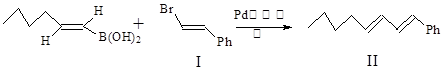

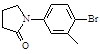 )与化合物(
)与化合物(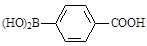 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。

 )
) CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
 Cr2O72-+ H2O
Cr2O72-+ H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号