反应4A(s)+3B(g) 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
在化学反应A(g)+3B(g)  2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
| A.vA=vB | B.vA=2vC | C.3vB=vC | D.vB=3vD |
在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L·s),则所经历的时间是
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L·s),则所经历的时间是
| A.0.44秒 | B.1秒 | C.1.33秒 | D.2秒 |
将0.5molPCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
A. |
B. |
C. |
D. |
把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g) xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
| A.5min内P的平均反应速率为0.15mol/(L·min) | B.Q的平衡浓度为1mol/L |
| C.Q的转化率为25% | D.x是2 |
某反应:2A(g) 3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
A、v(A)=0.1mol/(L.min) B、v(B)=0.2mol/(L.min)
C、v(A)=" v(B)" ="0.5" mol/(L.min) D、v(A)=" v(B)" ="0.3" mol/(L.min)
将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应: NH4Br(s)  NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)  Br2(g)+H2(g) 。2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用
Br2(g)+H2(g) 。2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用 (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
| A.0.5mol/(L·min) | B.2.5 mol/(L·min) | C.2 mol/(L·min) | D.5 mol/(L·min) |
在2A(g)+B(g) 3C(g)+4D(g)中,表示该反应速率最快的是 ( )
3C(g)+4D(g)中,表示该反应速率最快的是 ( )
A.υ(A) = 0.5mol·L-1·s-1 B.υ(B) =" 0.3" mol·L-1·s-1
C.υ(C) = 0.8mol·L-1·s-1 D.υ(D)=" 1" mol·L-1·s-1
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol / (L·s)
反应4A(g)+3B(g) 2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B.③ C.① D. ②④
在密闭容器中,进行可逆反应,A与B反应生成C,其反应速率分别为v1、v2、v3(单位:mol·L-1·s-1),且v1、v2、v3之间有如下关系:3v1=v2,2v1=v3,2v2=3v3,则此反应表示为
A.A+B C C |
B.2A+2B 3C 3C |
C.3A+B 2C 2C |
D.A+3B 2C 2C |
对反应4A+5B===4C+6D,以下化学反应速率的表示中,所表示反应速率最快的是
A. v (A)=0.40mol•L-1•s-1 B. v (B)=0.48mol•L-1•s-1
C. v (C)=0.36mol•L-1•s-1 D. v (D)=0.55mol•L-1•s-1
在一个容积为3L的密闭容器内进行如下反应:A2(g)+3B2(g) aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。计算a值、X的表示式(用A、B表示)、该反应的反应速率,并求出2min末的A2的浓度。
aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。计算a值、X的表示式(用A、B表示)、该反应的反应速率,并求出2min末的A2的浓度。
在 时,将
时,将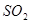 和
和 压入一个盛有催化剂的
压入一个盛有催化剂的 密闭容器中进行反应(
密闭容器中进行反应(

 ),2分钟时容器中剩下
),2分钟时容器中剩下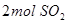 和
和 。则:
。则:
(1)2分钟内生成的 的物质的量是多少?
的物质的量是多少?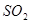 起始的物质的量是多少?
起始的物质的量是多少?
(2)2分钟内以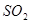 浓度变化表示的平均反应速率是多少?以
浓度变化表示的平均反应速率是多少?以 浓度变化表示的平均反应速率又是多少?
浓度变化表示的平均反应速率又是多少?
亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是 ,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快) ④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由 步反应决定。