设NA为阿伏加德罗常数的值。下列说法一定正确的是
| A.27 g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA |
| B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA |
| C.22.4 L氨气中含有N-H键的个数为3NA |
| D.Fe与水蒸气在高温条件下反应,有1 mol Fe参与反应,则转移电子的数目为3NA |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少为3.2g |
| B.0.5L1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA |
| C.Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA |
| D.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,2.24LO2中含有的共键数为0.4NA |
| B.0.1molH2S和0.1molSO2混合后,体系中的硫原子数0.2NA |
| C.100g质量分数为16.2%HBr溶液中的氢原子数为NA |
| D.3.9gNa2O2晶体中所含的离子总数为0.5NA |
Ⅰ、下表中括号内物质是杂质,试将除杂试剂及分离方法填入表内:
| 混合物 |
Fe ( Al) |
H2O(I2) |
| 除杂试剂 |
|
|
| 除杂方法 |
|
|
Ⅱ、等温等压下,等体积的O2和O3所含分子个数比为________, 质量之比为________。
Ⅲ、将适量的铁粉加入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+的物质的量浓度相等,则已反应的Fe3+和原溶液中的Fe3+的物质的量之比为 ;将绿豆大一粒钠投入硫酸铜溶液中,写出总的化学方程式 。
下列各组数据中,前者刚好是后者两倍的是( )
| A.2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-) |
| C.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
| D.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112 mL,原混合烃中乙炔的体积分数为
| A.12.5% | B.25% | C.50% | D.75% |
下列溶液中粒子的物质的量浓度关系一定正确的是( )
A.常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+)
C.向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+)
D.浓度均为0.1 mol·L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2 mol·L
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
实验室用18.4mol/L的浓硫酸来配制480mL 0.2mol/L的稀硫酸。
(1)所需玻璃仪器除了玻璃棒、烧杯外,还有 。
(2)所需量取浓硫酸的体积为 mL。
(3)下列操作对所配制的稀硫酸浓度有何影响?(用“偏高”“偏低”“无影响”填空)
A.用量筒量取浓硫酸时,洗涤量筒后将洗涤液转移到小烧杯中 。
B.定容时仰视刻度线 。
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L.下列叙述中正确的是( )
A.ω= ×100% ×100% |
B.c= |
C.可用装置 吸收氨气 吸收氨气 |
| D.上述溶液中再加入VmL水 ,所得溶液的质量分数大于0.5ω |
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下的实验:
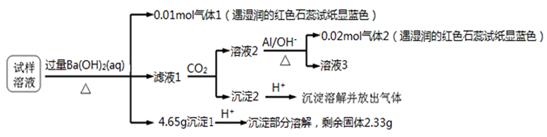
已知:3NO3-+ 8Al + 5OH- + 2H2O 3NH3 + 8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )
3NH3 + 8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )
| A.沉淀2为氢氧化铝 |
| B.Cl-一定存在,且n(Cl‑)≥0.05mol |
| C.该试样溶液中一定存在的离子有NH4+、Mg2+、Al3+、SO42-和NO3- |
| D.试样中可能存在Na+、Cl-、Al3+ |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL bmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
把V mL含有MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液,恰好使Mg2+完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4。则原混合溶液中K+的浓度为( )
A. mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
下列有关说法正确的是( )
| A.常温常压下,78gNa2O2中含有的阴离子数是NA |
B. m g 中所含电子数为(Z-n)mNA/A 中所含电子数为(Z-n)mNA/A |
| C.1L0.1mol/LFe(OH)3胶体中含有Fe(OH)3胶粒数为0.1NA |
| D.H2SO4的摩尔质量为98 |