某化学研究性学习小组实验需用90mL 1.0 mol·L-1 的NaCl溶液,现用氯化钠固体进行溶液配制,有如下操作步骤:
①用托盘天平称量____________g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______________________中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复) ;
(3)试分析下列操作对所配得溶液的浓度有何影响 (填:“偏高”、“偏低”、或“无影响”)
①用托盘天平称量 NaCl晶体时将砝码放在左盘,所配得溶液的浓度 ;
②定容时,仰视刻度线,所配得溶液的浓度 ;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,所配得溶液的浓度 。
实验室需要200mL0.2mol∙L-1NaOH溶液。现用NaOH固体配制,可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙;⑧100mL容量瓶;⑨250mL容量瓶。回答下列问题:
(1)上述仪器中,在配制NaOH溶液时必须使用的容器除①、③、⑥、⑦外,还有_________(填数字序号)。
(2)将所配置的NaOH溶液进行测定,发现浓度小于0.2mol∙L-1。请你分析配制过程中可能引起该误差的原因是(填字母序号)_______________。
A.定容时仰视 B.移液时没有洗涤烧杯和玻璃棒 C.配制时容量瓶有少量蒸馏水
(3)将配好的溶液盛装于下列(填字母代号)______________仪器中,贴好标签备用。
A.带玻璃塞的广口瓶 B.带玻璃塞的细口瓶
C.带胶塞的广口瓶 D.带胶塞的细口瓶
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为 mol·L-1(保留两位有效数字)。
(2)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是 。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用久置的NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是 。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
I.蒸馏是对混合物进行分离提纯的一种重要方法,其装置如图I。

(1)仪器a的名称是 。
(2)已知CCl4的沸点为76.7℃,甲苯的沸点为110.6℃。若要从它们的混合物中分离出CCl4,应将温度控制在 。
II.实验室需用230mL0.46 mol·L-1的稀硫酸,用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,则:
(1)需要量取该浓硫酸的体积为 mL;
(2)实验所用到的玻璃仪器除烧杯、玻璃棒外,还有 ;
(3)配制过程中部分步骤和操作如图所示:将上述实验步骤A—F按实验过程先后次序排列 。操作ABE用到了一种共同仪器,该仪器上标有:①温度、②浓度、③规格、④压强、⑤刻度线这五项中的 。(填数字符号)
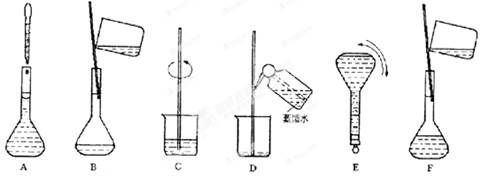
(4)该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是
| A.量取浓H2SO4时仰视刻度 |
| B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 |
| D.定容时仰视刻度 |
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制250 mL 1.0 mol/L的稀硫酸。可供选用的仪器有:

①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制上述稀硫酸时,还缺少的仪器有 、 (均写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为
(3)配制250 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留小数点后1位),量取硫酸时应选用___________________规格的量筒;
| A.10 mL | B.50 mL |
| C.100 mL | D.200 mL |
(4)根据计算结果,进行如下实验操作,其中错误的是_______________(填序号):
①用量筒取计算所需体积的浓硫酸;
②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;
③立即将稀释后的溶液转入容量瓶中;
④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;
⑤把容量瓶盖盖紧,上下颠倒摇匀。
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是_____________(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
(12分) 用CuSO4·5H2O配制500mL0.2 mol·L-1CuSO4溶液,在下列空格中填写所用仪器的名称及操作方法:
(1)需要的主要仪器名称有:烧杯、玻璃棒、天平(带砝码)、 和 ;
(2)经计算需要CuSO4·5H2O的质量为 克;
(3)移液时,需并用适量蒸馏水洗涤 和 2~3次,把洗涤液也移入容量瓶中,并摇匀;
(4)配制过程中的下列做法会使所配浓度偏高的有 ;偏低的有 ;无影响的有 。
| A.称量NaOH固体时,放在烧杯中且称量较慢 |
| B.称量NaOH固体时,砝码与药品位置颠倒(没用游码) |
| C.溶解搅拌时,溶液溅到烧杯外面 |
| D.移液前,容量瓶中有少量蒸馏水 |
E.移液时,忘记洗涤烧杯内壁
F.定容时,俯视刻度线
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。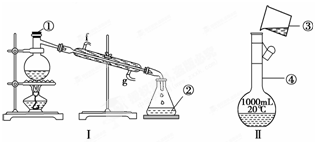
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
| A.Na2CO3·10H2O晶体失去了部分结晶水 |
| B.用“左码右物”的称量方法称量晶体(使用游码) |
| C.称量碳酸钠晶体时所用砝码生锈 |
| D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
(2)在容量瓶的使用方法中,下列操作不正确的是______
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
某学生欲配制6.0mol/L的H2SO4溶液980mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______________mol/L(保留1位小数)。
(2)该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、__________、___________。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部倒入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸,沿烧杯内壁倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._______________________________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧、振荡、摇匀。
(4)如果省略操作D,对所配置溶液浓度有何影响?________(偏大、偏小,无影响?)
(5)进行操作C前还需注意__________________________________________
实验室配制480 mL 0.1mol·L-1 NaOH溶液,回答下列问题
(1)应用托盘天平称取氢氧化钠固体 g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒 、 。使用容量瓶前必须进行的操作是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)定容时若加水超过刻度线,应如何处理? 。
(5)试分析下列操作对所配溶液的浓度有何影响。
A.偏高 B.偏低 C.不变(用符号回答)
①定容时俯视刻度线 ;
②放在滤纸上称量NaOH固体 。
③容量瓶没有干燥,有少量蒸馏水: 。
④定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度: 。
(6)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去 (标签如图)。

实验室需要0.1 mol·L-1NaOH溶液480mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
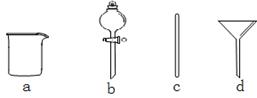
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
| A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡 |
| B.在盛有NaOH固体的烧杯中加入适量水溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于__________、后用于__________。
(4)根据计算用托盘天平称取的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol·L-1(填“大于”“小于”或“等于”)。
实验室用固体KCl配制0.5mol·L-1的KCl溶液450mL,有以下仪器:
①烧杯 ②胶头滴管 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦酒精灯 ⑧药匙
(1)配制时时必须使用的仪器有 (填代号)
(2)该实验两次用到玻璃棒,其作用分别是 、
(3)配制时一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀 ⑧冷却,其正确的操作顺序为
(4)试计算应称取的KCl固体的质量为 g。取出配制后的该KCl溶液10mL加水稀释到100mL,稀释后溶液中KCl的物质的量浓度是 。
(5)下列操作对KCl溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①摇匀后发现液面低于刻度线再加水______;
②容量瓶中原有少量蒸馏水_______;
③定容时俯视观察液面___________。
右图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:

(1)该盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液的浓度
B.溶液中氯化氢的物质的量
C.溶液中氯离子的数目
D.溶液的密度
(3)现用该浓盐酸配制250mL2mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤托盘天平;⑥玻璃棒。请回答下列问题:
①经计算,配制250ml2mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL;
②配制稀盐酸时,还缺少的仪器有 (写出仪器名称及规格);
③对所配制的稀盐酸进行测定,发现其浓度小于2mol/L,引起误差的原因可能是 。
A.定容时俯视容量瓶刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.溶液注入容量瓶前没有恢复到室温就进行定容
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)若在标准状况下,将VL氯化氢气体溶于1L水中,所得溶于密度为dg/mL,则此溶液的物质的量浓度为 mol/L。
A.  B.
B.  C.
C.  D.
D. 
现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
(1)称量:若需要配制460mL 0.1moL/L NaOH溶液,则应称取固体NaOH g;
(2)用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
(3)配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中;在液面接近容量瓶刻度线 处,改用 定容。
(4)若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).

(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)配制时,其正确的操作顺序是 。(字母表示,每个字母只能用一次)
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为: mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好。