(共18分)
(1)在同温同压下,等质量的CO和CO2,其体积之比为 ,电子数之比为 ,密度之比为 。
(2)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
(3)某金属氯化物MCl2 27g ,含有0.40molCl-,则该氯化物的物质的量为_ _____,摩尔质量为 ,金属M的相对原子质量为 。
【化学与技术】钛铁矿的主要成分可表示为FeTiO3(Ti 为+4 价),某钛铁矿中含FeTiO3 为76%。钛白粉在涂料、塑料、油墨、造纸等行业具有广泛的用途,钛白粉的主要成分为TiO2。利用该钛铁矿生产钛白粉及绿矾的工艺流程如下:

(1)若钛铁矿与浓硫酸反应时Ti 的转化率为92%,操作Ⅰ~Ⅳ中Ti 的转化率均为96%,则1t 该矿石可生产钛白粉(TiO2) t (计算结果保留两位小数,下同),能否计算生成的绿矾(FeSO4·7H2O)的质量? (能则写出计算结果,不能则说明理由)。
(2)钛铁矿与硫酸的反应可表示为FeTiO3+H2SO4 →TiOSO4+X+H2O(未配平)。其中X的化学式为 。
(3)操作Ⅰ的名称是 ,操作Ⅱ包括冷却结晶、 。操作Ⅱ中加入铁粉的目的是 (用离子方程式表示)。
(4)写出操作Ⅲ中TiOSO4水解的化学方程式: 。
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
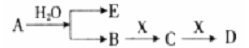
请回答下列问题:
(1)B中所含化学键的类型是___________。
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式 。
(3)①C也可转化为B,写出该转化的化学方程式____________。
②B与D反应的离子方程式为______________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
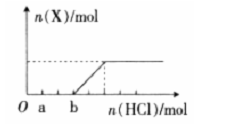
请回答:a 点溶液中所含溶质的化学式为_______,b 点溶液中各离子浓度由大到小的关系是______。
(8 分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 .
(4)100g上述产气药剂产生的气体通过碱石灰后得到N233.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
(1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品—含两种按盐的化肥。若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积分数以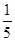 计),则处理废气时发生反应的总化学方程式为 。若该工厂用此方法处理废气,一天中消耗了空气336m3(假定反应中O2无损失),则生成化肥的总质量为 。
计),则处理废气时发生反应的总化学方程式为 。若该工厂用此方法处理废气,一天中消耗了空气336m3(假定反应中O2无损失),则生成化肥的总质量为 。
(2)该工厂废气中含有大量温室气体—CO2。为减少碳排放,该工厂尝试用以下反应制备甲醇: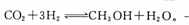 。一定温度下,在恒容的密闭容器中充入1 mol CO2和3mol H2。实验测得CO2和CH3 OH (g)的浓度随时间变化如下图所示。
。一定温度下,在恒容的密闭容器中充入1 mol CO2和3mol H2。实验测得CO2和CH3 OH (g)的浓度随时间变化如下图所示。
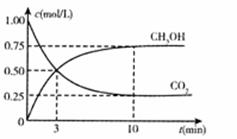
0-10分钟内,CH3 OH的生成速率为 ,达平衡时,CO2转化率为 ,若第 10min时,向容器中再通人3mol H2,再次达平衡时,CO2的转化率会 (填“增大”、“减小”或“不变”)。
将5.3 g某碱式碳酸盐固体(不含结晶水)M溶解于100 g 9.8%的稀硫酸中,充分反应后得到224 mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液。向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示。

(1)由图可知,固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2 (SO4)3外,还含有的溶质是______(写化学式)。
(2)加入的溶质NaOH从0.8 g到xg所发生反应的离子方程式为 。
(3)当加入溶质NaOH的质量到xg时,生成Al(OH)3的质量为 g,x= 。
(4)M的化学式为____。
(两个选项符合题意,6分)双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
18-II(14分)铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:

(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:________________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为______,其物质的量为____________。
(3)该钒土矿样中Al2O3的质量分数为________。
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在 极(填“阴”,“阳”)最多可制得金属铝________t。
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素 |
元素性质或结构 |
| A |
最外层电子数是其内层电子数的2倍 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 。
(2)B最简单气态氢化物的电子式 ,属于 化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式 ,所含化学键类型: 。
(3)B、C、D、E简单离子半径由大到小顺序为: ﹥ ﹥ ﹥ (填元素符号)。
(4)用电子式表示E的氢化物的形成过程 。
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式: 。
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为 。
(12分)煤、天然气是社会生产、生活中重要的能源。
(1)工业上常把煤进行气化和液化处理,使煤变成清洁能源.煤气化和液化流程示意图如下:
①已知H2、CO和CH3OH的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。写出由CO和H2合成甲醇的热化学方程式_________________
②煤进行气化和液化的优点是
(2) 天然气催化重整也可生成CO和H2
①500℃,向一体积可变的密闭容器中充入一定量CH4和水蒸气进行催化重整, 下列能说明反应一定处于平衡状态的是
| A.混合气体的密度不随时间变化 |
| B.CO和H2的体积分数之比不随时间变化 |
| C.v正(CH4)=3v逆(H2) |
| D.混合气体的平均相对分子质量不随时间变化 |
②CO和H2可用作燃料电池。一种熔融碳酸盐燃料电池原理示意如图:
写出A电极反应式__________________
(3)CO一旦泄露会造成污染,环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液恰好吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
则样品中CO的浓度为
28g KOH固体必须溶解在________g水中,才能使每200个水分子中有1个K+,所得溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为________。(保留到小数点后两位)
I.在标准状况下,由CO和CO2组成的混合气体4.48L,质量是8g。此混合物中CO和CO2的物质的量比是 ① ,CO的体积分数是 ② ,CO的质量分数是 ③ ,混合气体中C和O的原子个数比是 ④ ,混合气体的平均摩尔质量是 ⑤ 。
II.现有mg某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为________个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______________。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为____________,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为______________________________________________________
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是 ,其物质的量浓度为 mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质为 ,则该溶质物质的量浓度为 mol·L-1
I.下表是生活生产中常见的物质,表中列出了它们一种主要成分(其它成分未列出)
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
绿矾 |
醋精 |
苏打 |
酒精 |
铜导线 |
蔗糖 |
烧碱 |
| 主要 成分 |
FeSO4 |
CH3COOH |
Na2CO3 |
CH3CH2OH |
Cu |
C12H22O |
NaOH |
(1)请你对表中①~⑦的主要成分进行分类(填编号)
属于电解质的是 ,属于非电解质的是 。
(2)写出②与⑦反应的离子方程式
Ⅱ.5molCO的质量为 ,其中含有 个一氧化碳分子。(用NA表示)相同质量的H2、NO、 O2、Cl2四种气体中,含有分子数目最少的是 ,在相同温同压下,体积最大的是 。