(1)设1个12C的质量是a kg,1个Na的质量是b kg,则Na的摩尔质量是 ;
(2)10.0g 由2H和16O组成的水分子,其中质子数___________
(3)标准状况下,11.2 L CO和CO2混合气体质量为20.4 g,则混合气体中CO和CO2的体积比为
(4)19 g 某二价金属的氯化物ACl2中含有0.4 molCl-,A的相对原子质量
(5)N2在标准状况下的密度为 g/L 。
实验题:现需要90 mL 1.00 mol·L-1 NaCl溶液,某同学按下列步骤进行配制:
①计算所需NaCl固体的质量;
②称量NaCl固体;
③将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解;
④将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶;
⑤向容量瓶中加蒸馏水至刻度线。
请回答有关问题:
(1)计算所需NaCl固体的质量______g。
(2)为了加速溶解,可以采取的措施是_______________。
(3)使用容量瓶的规格是________mL。
(4)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求______________(填“大”或“小”)了。
(5)如果某同学是用托盘天平称量NaCl固体,那么称量的质量是 ,与计算量一致吗?解释原因___________________________。
现有m g某气体X2,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度是 。
(1)下列几种物质:①H2O、②Fe(OH)3胶体、③Mg、④蔗糖、⑤盐酸溶液、⑥Ca(OH)2、属于电解质的是 ,属于分散系的是 ;(用数字序号填空)
(2)含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
(3)已知: 2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-,Cl2+2Br-===2Cl-+Br2。 向含有1 mol FeI2和1mol FeBr2的溶液中通入2 mol Cl2,充分反应后,此时被氧化的离子是________;(填写离子符号),如果向上述原溶液中通入3 mol Cl2,充分反应后,此时所得溶液中含有的离子 。(填写离子符号,忽略水的电离)
实验室需要90 mL 浓度为1 mol·L-1的稀硫酸,现用18.0 mol·L-1的浓硫酸配制,其操作可分为以下各步:
| A.用量筒量取______mL浓硫酸; |
| B.缓缓注入盛有少量蒸馏水的烧杯中,并用玻璃棒不断搅拌后,____________; |
| C.用少量蒸馏水,洗涤烧杯和玻璃棒2-3 次,将每次洗液都倒入所选容量瓶里; |
| D.将稀释后稀硫酸小心倒入所选容量瓶里; |
E.检查所选容量瓶是否会发生漏液;
F.将蒸馏水直接加入容量瓶,至液面距离刻度线1—2cm 处;
G.盖紧瓶塞,反复上下颠倒,摇匀溶液;
H.用胶头滴管向容量瓶里逐滴滴入蒸馏水,目光平视,滴至_____________。
(1)填写上述各步的空白处。
(2)正确的操作顺序是E→A→B→D→_____________G (填写字母)。
(3)已经有的玻璃仪器包括玻璃棒,烧杯,10mL 量筒,还需要的玻璃仪器有___________。
按要求填写下列空格
①0.5molH2O约含______个质子;
②1.204×1024个水分子的质量为________g;
③5mol的CO2与8mol的SO2原子数比是_________;
④写出属于氧化还原反应但不属于化合反应、分解反应、置换反应和复分解反应的反应式一例:__________。
⑤写出Na3PO4在水溶液中的电离方程式:_______________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:(已知:NH4++OH- = NH3↑+H2O)
第一份加入AgNO3溶液有沉淀产生。
第二份加足量NaOH溶液加热后,收集到0.08 mol气体。
第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g.。根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- :
(2)由第二份进行的实验得知混合物中应含有 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g沉淀的成分为 ,计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是
| A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+) ≥0.04mol |
| B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- |
| D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
(1)0.3 mol H2O分子中所含氢原子数与______个NH3分子中所含氢原子数相等。
(2)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为_______,该混合气体的平均摩尔质量为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,那么c g氧气在标准状况下的体积约是______(用含NA的式子表示)。
(4)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式______________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为______________。
用18.4 mol·L-1的浓H2SO4配制100mL浓度为1 mol·L-1的稀H2SO4,其操作可分为以下各步:
| A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌; |
| B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中; |
| C.将稀释后的H2SO4小心转移到100mL容量瓶里; |
| D.检查100mL容量瓶口部是否会发生滴漏; |
E.用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)___________________。
②进行A步操作时,应选择下列量器______________(填序号)。
a.10ml量筒 b.50ml量筒 c.100ml量筒
如果对装有浓H2SO4的量筒读数如图所示,配制的稀H2SO4的浓度将_______________(偏高、偏低、无影响)

③进入A步操作后,必须___________________后才能进行C操作。
Ⅰ、现有A g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
Ⅱ、已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为 mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A 称量的是长期暴露在空气中的NaOH
B 容量瓶不干燥
C 将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D 混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
(1)通常状况下,已知X、Y两种气体,其质量分别为a、b时,体积之比为2:3。 两种气体X、Y的相对分子质量之比为________;相同条件下的X、Y两种气体,体积相同时,则X、Y的密度之比为__________;相同条件下,同质量的两种气体,X与Y的分子数之比为________。
(2)已知下列反应能发生:
2A3+ + 2B - = 2A2+ + B2;
C2 + 2B- = 2C- + B2;
2A2+ + C2 = 2A3++ 2C-
上述三个反应中氧化剂的氧化性强弱顺序为___________;还原剂的还原性强弱顺序为___________。
(3)一定条件下硝酸铵受热分解的化学方程式为: NH4NO3→HNO3+N2↑+H2O(未配平),写出配平后的化学方程式:________________________。在反应中被氧化与被还原的氮原子数之比为
(4)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
| A.野火烧不尽,春风吹又生 |
| B.春蚕到死丝方尽,蜡炬成灰泪始干 |
| C.粉身碎骨浑不怕,要留清白在人间 |
| D.爆竹声中一岁除,春风送暖入屠苏 |
水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
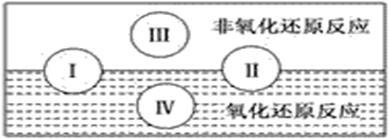
试写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________
用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸220ml。试回答下列问题:
(1)浓盐酸的物质的量浓度为 ;
(2)经计算,在量取浓盐酸时宜选用下列量筒中的 (填序号)。
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近刻度线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是( )
A.①②③④ B. ③④①②
C.④①②③ D.③①④②
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。
(1)0.6mol 的氧气与0.4mol臭氧质量之比为 ,氧原子个数之比为 ,标准状况下体积比为_____________。
(2)某元素的一种同位素原子X的质量数为a,含N个中子,它与H原子组成HmX分子,在1mol HmX中所含质子的物质的量是 mol。
实验室用纯碱(Na2CO3·10H2O)配制480mL 0.1mol/L Na2CO3溶液,实际操作步骤有:
(1)需称量纯碱的质量为___________g
(2)配制溶液时下列仪器中:
| A.锥形瓶 | B.托盘天平 | C.烧杯 | D.胶头滴管E.药匙 |
不需要用到的是_____(填序号),尚缺的玻璃仪器有_____和_____(写名称)。
(3)人们常将配制过程简述为以下各步骤:
A 冷却 B 称量 C 洗涤 D 定容
E 溶解 F 摇匀 G 转移 H 装瓶。
其正确的操作顺序应是_______ (填序号)。
①B E A G C G D F H ②B E G A C G F D H
③B E F G C G D H A ④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是______________ (填序号)
①纯碱晶体部分失水 ②容量瓶使用时未干燥
③移液时未洗涤烧杯和玻璃棒 ④定容时俯视刻度线观察液面
⑤定容时仰视刻度线观察液面
⑥摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线