NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
| B.1 mol -CH3和1 mol OH- 都含有10 NA个电子 |
| C.标准状况下3.36 L CCl4含碳原子数为0.15NA |
| D.1mol Na完全反应生成Na2O2时失去NA个电子 |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A.标准状况下,22.4L乙醇的分子数为NA |
| B.1mol甲基中含有的电子数为10NA |
| C.13g乙炔和苯的混合气体中含有原子总数为2NA |
| D.1L 0.1mol·L-1乙酸溶液中H+数目为0.1NA |
(1)某氯化镁溶液的密度为d g·cm-3,其中镁离子的质量分数为A%,则300 mL该溶液中c (Cl-)= (mol/L)。
(2)无土栽培中,需配制营养液NaH2PO4、Na2HPO4(物质的量之比为4 : 1),已知每升含磷元素0.10mol,现用4.0mol/LH3PO4和固体NaOH配制2 L该营养液需要:
V(H3PO4)= (mL),m(NaOH)= (g)。
(3)甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为 甲 : 乙=1 : 2,则加入铝粉的质量为: (g)。
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体 g。
(1)在该溶液的配制过程中,用到的玻璃仪器: 、胶头滴管、量筒、烧杯、玻璃棒。
(2)如果在定容时仰视,溶液浓度将 ;若定容时液面高于刻度线应采取的措施是 。
Ⅱ、取上述实验中配制的NaOH溶液100mL,缓慢通入一定量的CO2,充分反应,测得最后溶液呈碱性。
(1)此时溶液的溶质若是单一成分,可能是 或 。
(2)若果在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
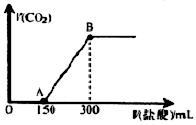
①由图可知,碱性溶液中的单一溶质为 。
②请写出0-A段所发生反应的离子方程式 。
③B点时,产生的CO2在标准状况下的体积为 mL;B点时,反应所得溶液中溶质的物质的量浓度是 mol/L(两种溶液混合时体积可以直接相加)。
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.在12 g单层石墨中,含六元环的数目为1NA |
| B.50mL 18.4mol·L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA |
| C.42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA |
| D.1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |
已知:MnO2+4HCl MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。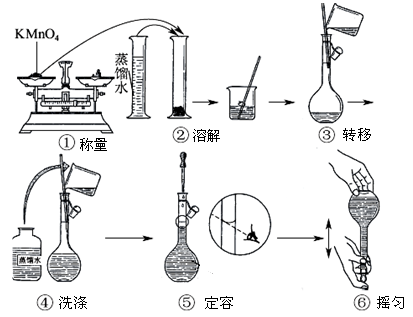
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为__________mol·L-1。
(2)下列容量瓶的使用方法中,不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.200 mol·L-1的稀盐酸。
① 该学生需要用量筒量取________mL上述浓盐酸进行配制。
② 在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有___________
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
设NA为阿伏加德罗常数的值,下列说法正确的是
①在标准状况下,1 mol氦气含有的原子数为NA
②46 gNO2和N2O4的混合物中含有的原子数为3NA
③标准状况下,5.6LCO2与足量Na2O2反应转移的电子数0.5NA
④0.5 mol•L-1 Na2CO3溶液中含有的Na+数目为NA
⑤常温下,当7.1gCl2全部溶于水,反应中转移的电子数等于0.1NA
⑥标准状况下,1L CCl4所含分子数为1/22.4 NA
⑦0.1 molCl2与过量的铁反应转移电子数为0.2 NA
| A.①②③④⑤ | B.①②⑦ | C.②③⑤⑥ | D.①③⑤ |
NA代表阿伏加德罗常数,下列说法正确的是:( )
| A.标准状况下,22.4LSO3所含原子数为4NA |
| B.1.0L浓度为1.0 mol/L的一元酸溶液中含有NA个氢离子 |
| C.7.8g Na2O2加入过量水中,反应转移的电子数为0.2 NA |
| D.同温同压下,原子数均为NA的氢气和氦气具有不同的体积 |
标准状况下,10 g由CO和CO2组成的混合气体的体积为 6.72 L,则混合气体中CO和CO2的物质的量之比是
| A.2:1 | B.2:3 | C.4:3 | D.1:1 |
有某温度下KCl饱和溶液m1 g,溶质质量分数为ω1%。对其蒸发结晶或降温结晶,若析出KCl的质量、所得母液质量及溶质质量分数用m g、m2 g和ω2%表示,分析正确的是
| A.原条件下KCl的溶解度小于ω1 g | B. m1∙ω1%- m = m2∙ω2% |
| C.ω1一定大于ω2 | D. m1 - m2 ≤ m |
以下数值等于阿伏加德罗常数值的是
| A.6g石墨中的C-C键数目 |
| B.常温常压下,17gND3中所含分子数目 |
| C.向含0.2molNH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
| D.0.1mol羟基(-OH)中所含电子数目 |
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质: NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:_________________;
(3)在反应:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+中,得电子的元素为__________________,5molS2O82-参加反应时转移电子物质的量为_____________。