设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是
| A.2 L溶液中阴阳离子总数为1.2NA |
| B.500 mL溶液中NO3-浓度为0.2 mol/L |
| C.500 mL溶液中Ba2+浓度为0.2 mol/L |
| D.500 mL溶液中NO3-物质的量为0.2 mol |
铁、铜混合粉末18.0 g 加入到100 mL 5.0 mol/LFeCl3溶液中,剩余固体质量为3.2 g。下列说法正确的是
| A.剩余固体是铁、铜混合物 |
| B.原固体混合物中铜的质量是9.6 g |
| C.反应后溶液中n(Fe3+)="0.10" mol |
| D.反应后溶液中n(Fe2+)+ n(Cu2+)="0.5" mol |
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
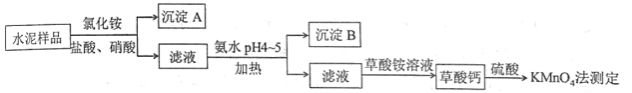
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
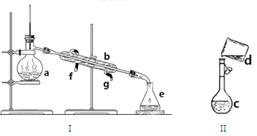
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。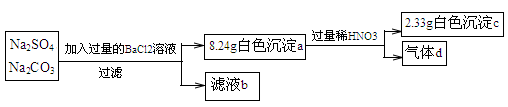
下列说法不正确的是
| A.沉淀a的主要成分是BaSO4和BaCO3 |
| B.滤液b中Na+的物质的量为0.08mol |
| C.气体d在标准状况下的体积为224mL |
| D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3 |
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
实验室用氢氧化钠固体配980 m L0.1mol/ L的氢氧化钠溶液。
(1)配制过程的正确操作顺序(用①②③……表示)________________
①、计算所需固体氢氧化钠的质量________克;
②、将称取的固体氢氧化钠放在洁净的烧杯内,加约50─100 m L水,搅拌溶解并冷却至室温;
③、用天平称取所需量的固体氢氧化钠;
④、将溶液移入________中;
⑤、用蒸馏水洗涤烧杯内壁2─3次,将每次洗液全部移入容量瓶中,摇匀;
⑥、改用胶头滴管小心滴加蒸馏水至刻度线;
⑦、继续往容量瓶里加蒸馏水到液面接近刻度线1─2厘米处;
⑧、加盖瓶塞,反复摇匀;
(2)在上述步骤⑥时俯视,则所配置的溶液浓度会_________,若遗漏步骤⑤,则所配溶液浓度会______________。(填“偏高”、“偏低”或“不影响”)
盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。则原混合气体中O2和NO2的体积比是( )
| A.2∶1 | B.1∶2 | C. 3∶2 | D.3∶1 |
6.32g的KMnO4与过量的浓盐酸完全反应,化学方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,回答下列问题:
(1)用双线桥标出反应中电子转移的方向和数目并指出反应中的氧化剂、还原剂。
(2)产生的Cl2在标准状况下的体积是多少?
(3)被氧化的HCl的物质的量是多少?
如果规定:1mol粒子集体所含的粒子数与0.024kg12C中所含的碳原子数相同,下列各项中发生变化的共有:①摩尔质量②摩尔体积③物质的量浓度④溶解度⑤质量百分数⑥密度⑦阿伏加德罗常数⑧相对原子质量⑨相对分子质量⑩相对密度
| A.3 | B.4 | C.5 | D.6 |
计算题两瓶不同浓度的氢氧化钠溶液各取100ml,分别通入CO2 2.24L(标准状况)。完全反应后,将溶液低温缓慢蒸干,分别得到不含结晶水的固体10.0g、11.6g,判断这两种固体的组成成分,并计算原两瓶氢氧化钠溶液的物质的量浓度各是多少?
只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是
| |
① |
② |
③ |
④ |
⑤ |
| 甲 |
物质微粒数 |
标况下气体摩尔体积 |
固体体积 |
溶液的质量分数 |
非标况下物质的质量 |
| 乙 |
阿伏加德罗常数 |
标况下气体体积 |
固体密度 |
溶液的体积 |
物质的摩尔质量 |
A.②③④ B.③④⑤ C.③④ D.①③