CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴
⑵ 。
工业废水中常含有一定量的和
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:
(1)若平衡体系的,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.和
的浓度相同
b.
c.溶液的颜色不变
(3)第②步中,还原1mol离子,需要mol的
。
(4)第③步生成的在溶液中存在以下沉淀溶解平衡:
常温下,的溶度积
,要使
降至
,溶液的
应调至。
方法2:电解法
该法用做电极电解含
的酸性废水,随着电解进行,在阴极附近溶液
升高,产生
沉淀。
(5)用做电极的原因为。
(6)在阴极附近溶液升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应: 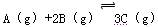 ,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题,
(1)该反应的平衡常数K随温度升高而 (填“增大”、“减少”或“不变”),该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
(3)30℃时,若在同一容器中加入3 molA、4 molB和 molC,则平衡混合气中C的体积分数仍为ω,此时平衡时体系中A的物质的量浓度为 mol·L-1。
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)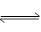 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 增大压强K值将 (填“增大”、“减小”或“不变”)。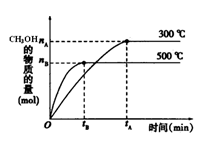
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nA 、nB、 tA 、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a. v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d. CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a. c(H2)减少 b正反应速率加快,逆反应速率减慢
c. CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式: 。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度 (填增大、不变或减小,下同),NH3的体积分数 。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时 存在:W(s)+I2(g) WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
(1)求943K时此反应的平衡常 数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2 达平衡,此时容器中各气体的体积 比:___________,当同时加入等物质的量I2(g) 和WI2(g),平衡___________方向移动(填正反 应、逆反应或不移动)
⑶画出W(s) + I2(g)  WI2(g) △H<0时 间—速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时 间—速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g)  WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中,(如右图):容器中发生以下的反应:
N2(g)+3 H2(g) 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向 方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是 。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)="0.049" mol·L-1,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
1 000 ℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g);ΔH>0
Na2S(s)+4H2O(g);ΔH>0
若反应在恒温恒容状态下进行,回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入
Na2SO4___________________________________________________________________。
②加入焦炭
_____________________________________________________________________。
(2)若将容器温度升高20 ℃,H2在混合气体中的含量变化用下图中______图表示最合适。