2011年全国统一高考理综试卷(天津卷)化学部分
化学在人类生活中扮演着重要角色,以下应用正确的是
| A. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B. | 为改善食物的色、香、味并防止变质,可在其中加入大最食品添加剂 |
| C. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D. | 天然药物无任何副作用,可长期服用 |
以下有关原子结构及元素周期律的叙述正确的是()
| A. |
以ⅠA族元素铯的两种同位素比多4个质子 |
| B. |
同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C. |
第ⅦA族元素从上到下,其氢化物得稳定性逐渐增强 |
| D. |
同主族元素从上到下,单质的熔点逐渐降低 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
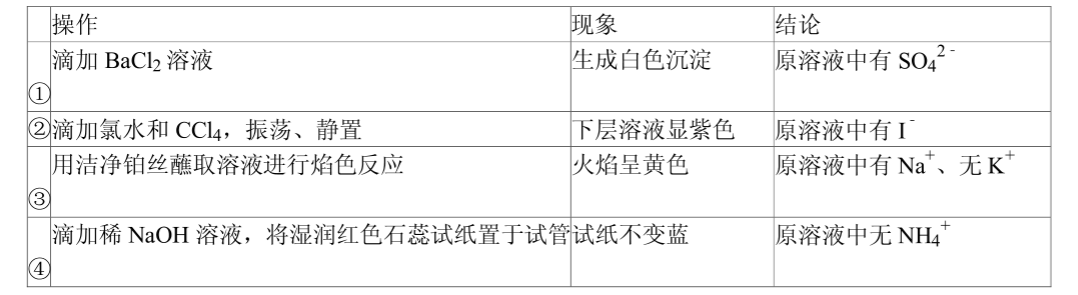
| A. |
① |
B. |
② |
C. |
③ |
D. |
④ |
25℃时.向100.01溶液中滴加0.01苯酚溶液.混合溶液中粒子浓度关系正确的
A.>7时.()>
B.<7时.
C.[]=10时.()=()>()=()
D.[]=20时.()+()=2()
下列说法正确的是
 时
溶液的
大于
时
溶液的
大于
 时
溶液的
时
溶液的
 时,将
=2的盐酸与
=12的
溶液等体积混合,溶液显中性
时,将
=2的盐酸与
=12的
溶液等体积混合,溶液显中性
向绝热恒容密闭容器中通入
和
,一定条件下使反应
达到平衡,正反应速率随时间变化的示意图如下所示。
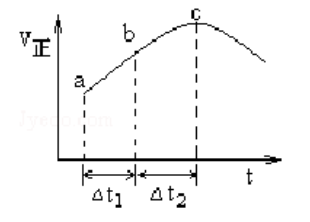
| A. | 反应在 点达到平衡状态 |
| B. | 反应物浓度: 点小于 点 |
| C. | 反应物的总能量低于生成物的总能量 |
| D. | 时, 的转化率: 段小于 段 |
图中、、为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,俗称磁性氧化铁:是不溶于水的酸性氧化物,能与氢氟酸反应。

回答下列问题:
(1)组成单质的元素在周期表中的位置是
(2)一定条件下,与反应生成,的电子式为
(3)已知与1 反应转化为时(所有物质均为固体)。放出热量。写出该反应的热化学方程式:
。
(4)写出和的稀溶液反应生成G的离子方程式:
(5)问含4 的稀溶液中,逐渐加入粉末至过量。假设生成的气体只有一种,请在坐标系中画出
随变化的示意图,并标出的最大值。
已知:
1.冠心平是降血脂、降胆固醇的药物,它的一条合成路线如下

(1)为一元羧酸,8.8 与足量溶液反应生成2.24(标准状况),的分子式为。
(2)写出符合分子式的所有甲酸酯的结构简式:
。
(3)是氯代羧酸,其核磁共振氢谱有两个峰,写出的反应方程式:。
(4)的反应类型为。
(5)写出和的结构简式:
_; 。
(6)的苯环上有两种氢,它所含官能团的名称为;写出所代表的试剂:; 。
Ⅱ.按如下路线,由可合成高聚物:

(7)的反应类型为.
(8)写出的反应方程式:_。
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:

 ;
;
的制备原理: ↑+,并设计出原料气的制备装置(如图)
↑+,并设计出原料气的制备装置(如图)

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氦气,丙烯。写出化学方程式:
(2)若用以上装置制备干燥纯净的,装置中和的作用分别是
和中承装的试剂分别是
(3)制丙烯时,还产生少量,及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和溶液 ②酸性溶液 ③石灰水
④无水 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:① (饱和)→↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
粗品 滤液
滤液
 有机层
有机层 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品
试剂1为
工业废水中常含有一定量的和,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:
(1)若平衡体系的,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.和的浓度相同
b.
c.溶液的颜色不变
(3)第②步中,还原1mol离子,需要mol的。
(4)第③步生成的在溶液中存在以下沉淀溶解平衡:
常温下,的溶度积,要使降至,溶液的应调至。
方法2:电解法
该法用做电极电解含的酸性废水,随着电解进行,在阴极附近溶液升高,产生沉淀。
(5)用做电极的原因为。
(6)在阴极附近溶液升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号