空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。

工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 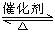 2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3)(填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) :c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g) 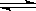 2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g) 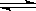 2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。

有X、Z、W三种含14个电子的粒子,其结构特点如下:
| 粒子代码 |
X |
Z |
W |
| 原子核数目 |
单核 |
同元素构成的两核 |
同元素构成的两核 |
| 粒子的电性 |
电中性 |
两个负电荷 |
电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气) 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。

a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g) 2C(g) 右反应室:2Z(g)
2C(g) 右反应室:2Z(g) X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:

(1)A(g)+2B(g) 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A 减少Fe的量 B 增加Fe2O3的量 C 移出部分CO2
D 提高反应温度 E 减小容器的容积 F 加入合适的催化剂
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:

(1)压强 P1比P2 (填大或小);(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)写出镁在CO2中燃烧的化学方程式为_________ _ ____。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是__________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 ____________________。



图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ ________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________。
根据下表所示化学反应与数据关系:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
① |
 |
1.47 |
2.15 |
②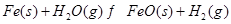 |
 |
2.38 |
1.67 |
③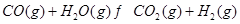 |
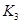 |
? |
? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号)。
A 缩小反应容器的容积 B 扩大反应容器的容积 C 升高温度
D 使用合适的催化剂 E 设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时 ,t8时 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出 ~
~ 时逆反应速率与时间的关系线。
时逆反应速率与时间的关系线。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
| c(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
减少污染、保护环境是全世界最热门的课题。请回答下列问题:
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3、
(2)污染物CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在恒容体系中,可以判断反应达到平衡状态的依据是 (填序号).
a. v正(CH3OH)= v逆(CO) b.混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. c(CO):c(H2): c( CH3OH)= 1:2:1
②在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如下图

M、N、Q三点的平衡常数KM、KN、KQ的大小关系为____ __。
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②若加入1mol空气(含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K(写出计算过程,计算过程中数据可作近似处理)
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)  H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
④ 目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
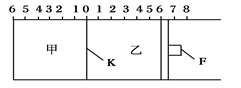
(1)达到平衡后隔板K是否可能处于0刻度_______(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为__ __mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。

(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba (NO3)2溶液,生成的BaSO4质量为________g。
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)一定条件下,能说明该反应达到化学平衡状态的是 (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) =" 0.0080" mol﹒L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+CO2(g) 2CO(g)△H=" +172.5" kJ•mol-1
2CO(g)△H=" +172.5" kJ•mol-1
则反应CO(g)+H2O(g) CO2(g)+H2(g) △H= ____________________。
CO2(g)+H2(g) △H= ____________________。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为______________________________。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
1其它条件不变,降低温度,达到新平衡前 v(逆) _____ v(正) (填“>”、“<”或“=”) 。
2该温度下,此反应的平衡常数K=____________________________;
3其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。