某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: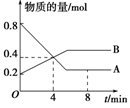
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为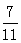 ,则SO2的转化率为 。
,则SO2的转化率为 。
将E 和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)  2G(g)。
2G(g)。
若忽略固体体积,平衡时 G 的体积分数随温度和压强的变化如下表所示。请填写下列空格:
(1)表中数据b f。(选填“>”、“<”或“=”)
(2)该反应的熵变ΔS 0,ΔH 0。(选填“>”、“<”或“=”)
(3)根据表中数据,可计算求得915℃、2.0MPa时E 的转化率为 。
(4)上述反应达到平衡后,若保持体系温度不变,下列措施中能提高混合体系中气体E的体积分数的是
| A.保持容器容积不变,充入一定量的气体 E |
| B.保持容器内压强不变,充入一定量的气体 G |
| C.加入少量固体F的粉末 |
| D.保持容器容积不变,同时充入一定量的气体 E 和G |
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。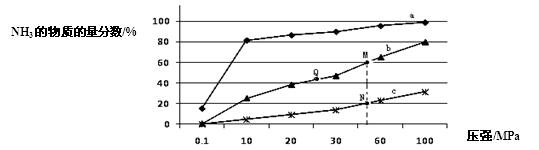
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
在压强为0.1 MPa、10L恒容的密闭容器中,将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g) CH3OH(g) ΔH<0请回答下列问题:
CH3OH(g) ΔH<0请回答下列问题:
(1)①该反应的熵变ΔS 0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1) K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是 ;
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为 mol;
②反应的平衡常数K= ;
③反应在0-5min区间的平均反应速率v(H2)= 。
(15分)甲醇是重要的化工原料,在化工生产中有广泛的应用。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH。写出相应反应的化学方程式: 。
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇。已知:
光催化制氢:2H20(1)=2H2(g)+O2(g)  H=+571.5 kJ·mol-1
H=+571.5 kJ·mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H20(1)  H= 一137.8 kJ·mol-1
H= 一137.8 kJ·mol-1
则反应:2H2O(1)+C02(g)=CH30H(l)+3/202(g)的 H= kJ·mol-1
H= kJ·mol-1
(3)已知反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H=Q
H=Q
在20 L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195 ℃时n(H2)随时间的变化如表所示。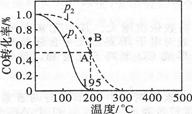

①O~3 min,平均速率V(CH3OH)= ,Q 0(填“<”“=”或“>”)。
②图中压强(P1、P2)的大小顺序为 ,理由是 。
③在P2及195 ℃时,该反应的平衡常数K= 。
Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| α/% |
0 |
33 |
42 |
49 |
59 |
73 |
74 |
75 |
75 |
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。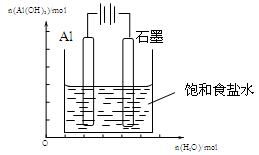
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH="+206.0" kJ·mol―1
CO(g)+3H2(g) ΔH="+206.0" kJ·mol―1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
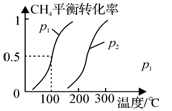
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应:CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
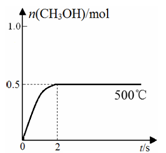
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g) ΔH="―29.1" kJ·mol―1,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) ΔH="―29.1" kJ·mol―1,科研人员对该反应进行了研究,部分研究结果如下:
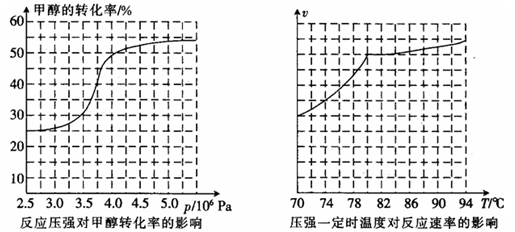
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数
5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数 随时间的变化如下图所示:
随时间的变化如下图所示:
①0~0.5min内的平均反应速率v(CO)= _____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是______。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则: _____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
_____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
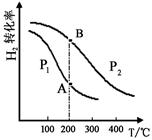
压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。

①写出阳极电极反应式_____________________________________________________________;
②写出除去甲醇的离子方程式_______________________________________________________。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为___________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH="—196.6" kJ/mol ;
2SO3(g) ΔH="—196.6" kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH="—113.0" kJ/mol ;
2NO2(g) ΔH="—113.0" kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________。
SO3(g)+NO(g) ΔH 的ΔH=________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1 mol SO3的同时生成1 mol NO2 |
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________ 。
各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.
Ⅰ.已知:汽车尾气处理的反应之一:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下左图所示.
①该反应第一次达到平衡时的平衡常数为__________。
②第12min时改变的条件是___________(填“升温”、“降温”),判断的依据是____________________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”).
Ⅱ.含有乙酸钠和对氯苯酚 的酸性废水,可利用微生物电池法除去,其原理如上右图所示
的酸性废水,可利用微生物电池法除去,其原理如上右图所示
①B是电池的______极(填“正”或“负”);
②酸性条件下,A极的电极反应式为______________________________。
③设电极两边溶液分别为1L,反应一段时间后,A极区溶液的pH从4变到1,此过程中处理的乙酸钠的质量为_________g 。
环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)="==" 4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) ="==" 2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 =" -1251" kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
(2)用活性炭还原法也可处理氮氧化物。有关反应为:C(s)+2NO(g)  N2 (g)+CO2 (g)
N2 (g)+CO2 (g)
某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol。
①0min~10min内以v(NO)表示的平均化学反应速率为 。
②下列各项能判断该反应达到平衡状态的是 。
| A.容器内压强保持不变 |
| B.速率关系:2v(NO)(正) =" v" (N2)(逆) |
| C.容器内CO2的体积分数不变 |
| D.混合气体的密度保持不变 |
③在相同条件下,若在容器中放入生石灰,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
某温度下,将4.0 mol的HI气体充入1 L已经抽空的固定容积的密闭容器中,发生如下反应:2HI(g) H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n /mol |
0 |
40 |
80 |
120 |
| n(HI) |
4.0 |
2.8 |
b |
c |
| n(H2) |
0 |
a |
1.0 |
1.0 |
(1)a = ,c = ;
(2)计算在该温度时此反应的平衡常数K = ;
(3)保持温度不变,120 s时再通入2.0 mol的H2。当再次达到平衡时,HI的平衡转化率是多少?(本小题要有适当的解题过程)