在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g) 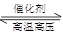 2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
| A.图Ⅰ研究的是温度对反应的影响,且甲的温度比乙的高 |
| B.图Ⅱ研究的是温度对反应的影响,且甲的温度比乙的高 |
| C.图Ⅱ研究的是压强对反应的影响,且甲的压强比乙的大 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲使用的高 |
一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压X物质的量分数。在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便。下列说法不正确的是( )
A.对于C2H4 (g) + H2O(g) = C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1 mol,则用分压表示的平衡常数Kp = 3/P
B.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)=2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动
C.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)=2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充人3molN2,则平衡正向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I=I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmol•L-1的Na2S203溶液进行滴定(反应为I2+2Na2S203 2NaI+Na2S406),消耗V2mL的Na2S203溶液。 根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
| A.方案可行,能准确测定溶液中的c(I2) |
| B.方案可行,可采用淀粉做该滴定反应的指示剂 |
| C.不可行,只能测得溶液中c(I2)与c(I3-)之和 |
| D.不可行,因为I能与Na2S203溶液反应 |
已知2NO2 N2O4 + Q (Q﹥0),将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4 + Q (Q﹥0),将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是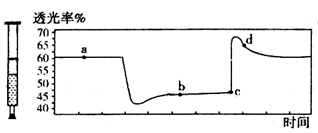
| A.c点的操作是拉伸注射器 |
| B.b点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb |
D.d点: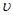 (正)> (正)> 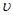 (逆) (逆) |
工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
A.反应的化学方程式:CO + 2H2  CH3OH CH3OH |
| B.反应进行至3分钟时,正、逆反应速率相等 |
| C.反应至10分钟,ʋ(CO) =" 0.075" mol/L·min |
| D.增大压强,平衡正向移动,K增大 |
在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
| A.气体的平均分子量不再变化 | B.反应的平衡常数不变 |
| C.ʋ(H2) =" 2" ʋ(HI) | D.气体的颜色不再变化 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
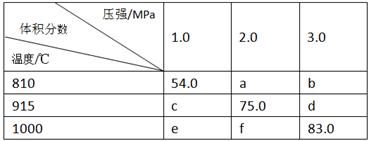
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
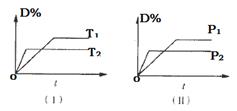
| A.降温,化学平衡向逆反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m<p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g) xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )

| A.P3<P4,y轴表示B的体积分数 |
| B.P3<P4,y轴表示混合气体的密度 |
| C.P3>P4,y轴表示B的百分含量 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
一定温度下,在固定容积的密闭容器中,发生可逆反应2A(g)+3B(s) 2C(g),下列叙述不是达到平衡的标志的是( )
2C(g),下列叙述不是达到平衡的标志的是( )
①单位时间生成a mol A,同时消耗1.5a mol B
②C的生成速率与C的分解速率相等
③各组分的浓度不再变化
④混合气体的密度不再变化
⑤混合气体的总压强不再变化
⑥A、B、C的分子数目比为2:3:2
⑦混合气体的平均摩尔质量不再变化
⑧混合气体的物质的量不再变化
A.④⑥⑦ B.⑤⑥⑧ C. ①③④ D.①⑤⑧
反应3H2(g) + N2(g) 2NH3(g) ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
2NH3(g) ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |
下列说法不正确的是
| A.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| B.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| C.属于放热和熵增加的反应,就更易自发进行 |
| D.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |