在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是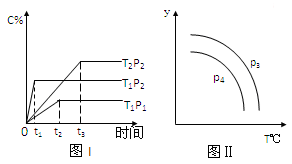
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
可逆反应:3A 3B+C △H>0,已知反应物A为气态物质,随着温度的升高,反应体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
3B+C △H>0,已知反应物A为气态物质,随着温度的升高,反应体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
①若C为固体,则B一定是气体 ②B和C一定都是气体
③B和C可能都是固体 ④B和C可能都是气体
| A.①② | B.②③ | C.①④ | D.③④ |
下列事实,其中不能用平衡移动原理解释的是
| A.向0.1mol/L的CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 |
B.在密闭容器中充入一定量NO2建立2NO2(g)  N2O4(g)平衡后,增大压强,体系颜色加深 N2O4(g)平衡后,增大压强,体系颜色加深 |
| C.向水中投入金属Na,最终溶液呈碱性 |
| D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。下列说法正确的是( )

| A.CO合成甲醇的反应为吸热反应 |
| B.该反应在T1时的平衡常数比T2时的大 |
C.平衡常数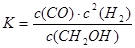 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
一定温度下,10mL0.4mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:( )
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| V(O2)/mL |
0.0 |
9.9 |
17.2 |
22.4 |
26.5 |
29.9 |
下列叙述错误的是(溶液体积变化忽略不计)
A.反应至6min时,c(H2O2)=0.20mol/L
B.反应至6min时,H2O2分解了40%
C.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
如图是温度和压强对反应X+Y 2Z影响的示意图。下列叙述正确的是( )
2Z影响的示意图。下列叙述正确的是( )

| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种是气态,Z为气态 |
| D.上述反应的正反应的△H>0 |
符合图1、图2的反应是
A.X(g)+3Y(g) 2Z(g);ΔH>0 2Z(g);ΔH>0 |
B.X(g)+3Y(g) 2Z(g);ΔH<0 2Z(g);ΔH<0 |
C.X(g)+2Y(g) 3Z(g);ΔH<0 3Z(g);ΔH<0 |
D.5X(g)+3Y(g) 4Z(g);ΔH<0 4Z(g);ΔH<0 |
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) 2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
| A.升高温度,X的物质的量减小 |
| B.增大压强(缩小容器体积),Z的浓度不变 |
| C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 |
| D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
一定温度下,能说明反应A(g)+2B(g) 3C(g)已达到平衡状态的是( )
3C(g)已达到平衡状态的是( )
| A.C的生成速率与C的分解速率相等 |
| B.单位时间内消耗amolA,同时生成3amolC |
| C.容器内压强不再变化 |
| D.混合气体的物质的量不再变化 |
对于固定体积的密闭容器中进行的气体反应A(g)+B(g)  C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
①反应容器中压强不随时间而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④反应混合气体的密度不随时间而变化
| A.①④ | B.①③ | C.③④ | D.②③ |
下列情况不能用勒夏特列原理解释的是
| A.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 |
| B.常温下,铁、铝在浓硝酸中钝化 |
| C.侯氏制碱中,降温析出副产品NH4Cl之前,向溶液中既洒NaCl固体又通入足量NH3 |
| D.夏天,打开冰镇汽水瓶,立即冒出大量泡沫 |
可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )


在一个容积为6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生反应:4X(g)+nY(g) 2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
| A.3 | B.4 | C.5 | D.6 |
下列事实中,不能用勒夏特列原理解释的是( )
| A.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.对熟石灰的悬浊液加热,悬浊液中固体质量增加 |