有下列五个化学方程式(X、Y、Z均为正值):
①C2H2(g)+H2(g) C2H4(g)
C2H4(g)
②CH4(g) H2(g)+
H2(g)+ C2H4(g)
C2H4(g)
③C(s)+2H2(g) CH4(g);△H=-X kJ·mol—1
CH4(g);△H=-X kJ·mol—1
④C(s)+ H2(g)
H2(g)
 C2H2(g);△H=-Y kJ·mol—1
C2H2(g);△H=-Y kJ·mol—1
⑤C(s)+H2(g)
 C2H4(g);△H=-Z kJ·mol—1
C2H4(g);△H=-Z kJ·mol—1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③—⑤式中关于X、Y、Z的大小顺序排列正确的是
| A.X>y>Z | B.X>Z>Y | C.Y>X>Z | D.Z>X>Y |
某温度下在密闭容器中发生如下反应:2SO2+O2 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
| A.20% | B.40% | C.50% | D.60% |
某可逆反应:mA(气)+nB(气) pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是
pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是
| A.m+n>pΔH>0 | B.m+n>pΔH<0 |
| C.m+n<pΔH>0 | D.m+n<pΔH<0 |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
| A.①②④ | B.②③ | C.②③④ | D.只有④ |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |
在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
| A.若正反应为吸热反应,则A为非气态 |
| B.若正反应为放热反应,则A为气态 |
| C.若在平衡体系中加入少量C,则该平衡不移动 |
| D.压强对该平衡的移动无影响 |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g)△H = -197kJ/mol。实验测得起始、平衡时的有关数据如右表所示。下列叙述正确的是
2SO3(g)△H = -197kJ/mol。实验测得起始、平衡时的有关数据如右表所示。下列叙述正确的是
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
A.Q1=Q2=Q3
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.若在上述条件下反应生成2molSO3(s)的放热大于197kJ
已知(HF)2 (g) 2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是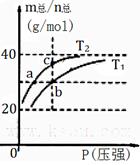
| A.温度: T1<T2 |
| B.平衡常数:K(b)<K(c) |
| C.反应速率:vb>va |
| D.当m总/n总= 30g/mol时,n(HF):n[(HF)2]=2:1 |
一定温度下,反应2SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是
| A.0.4mol | B.0.6mol | C.0.8mol | D.1.2mol |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.往K2CrO4溶液中加酸,使溶液橙色加深 |
| D.Fe(SCN)3溶液中加入几滴6mol/L NaOH溶液后溶液颜色变浅 |
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )

| A.Z和W在该条件下均为非气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的 平均摩尔质量不可能相等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是( )
A、容器①中达到平衡时,Y2的转化率为50%
B、Q="27.78" kJ
C、相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D、容器①、②中反应的平衡常数相等,K=
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g) 2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
| 容器 |
甲 |
乙 |
丙 |
| 相关条件 |
恒温恒容 |
绝热恒容 |
恒温恒压 |
| 反应物投料 |
1mol A2、3mol B2 |
2mol AB3 |
2mol AB3 |
| 平衡时容器体积 |
V甲 |
V乙 |
V丙 |
| 反应的平衡常数K= |
K甲 |
K乙 |
K丙 |
| 平衡时AB3的浓度/mol·L-1 |
c甲 |
c乙 |
c丙 |
| 平衡时AB3的反应速率/mol·L-1·min-1 |
v甲 |
v乙 |
v丙 |
下列说法正确的是 ( )
A、v甲=v丙 B、c乙>c甲 C、V甲>V丙 D、K乙<K丙
下列不能用勒夏特列原理解释的是( )
①热的纯碱溶液去油污效果好
②新制的氯水在光照条件下颜色变浅
③在H2、I2(g)和HI组成的平衡体系中,加压,混合气体颜色变深
④饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
⑤高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应
⑧收集氯气用排饱和食盐水的方法
⑨可用浓氨水和氢氧化钠固体快速制取氨气
| A.②③⑤⑥ | B.③⑤⑥⑨ | C.③⑤⑥⑦ | D.④⑥⑦⑨ |