NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为:
2CO+2NO=N2+2CO2,为了控制大气污染,下列措施切实可行的是( )
| A.改变压强 | B.提高温度 |
| C.使用催化剂 | D.用耐高压储气罐收集尾气,集中处理 |
升高温度,下列数据不一定增大的是
A.化学反应速率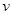 |
B.弱酸的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
可逆反应在一定条件下达到化学反应限度时,下列说法正确的是
| A.反应停止了 |
| B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 |
| D.正反应速率和逆反应速率相等 |
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是




图1 图2 图3 图4
| A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化 |
| C.图3表示分别稀释1 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL |
D.图4表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.若向容器中充入惰性气体,则平衡向右移动 |
| D.物质A一定为非气态,且正反应是吸热反应 |
下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水的方法收集氯气 |
| B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体 |
| C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀 |
| D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体 |
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是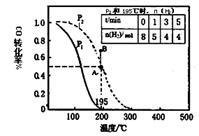
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是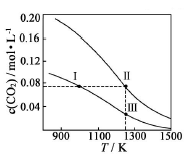
A.反应CO2(g)+C(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态)) |
在一定温度下,X 与 Y 发生反应:X(aq)+m Y(aq)  n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
| A.m :n =" 3" :2 | B.K = 8 |
C.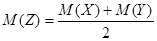 |
D.起始物质的量n(X)=1mol |
下列图示与对应叙述相符合的是
A.图I:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
B.图Ⅱ:反应H2+I2 2HI达平衡后,升高温度时反应速率随时间的变化 2HI达平衡后,升高温度时反应速率随时间的变化 |
C.图III:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
D.图IV:反应2SO2+O2 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 |
下列有关说法错误的是
| A.室温下的某NaF溶液中,c(H+)=1×10-10 mol∙L-1,说明NaF使水的电离减弱 |
| B.Mg在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 |
| C.纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应 N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
下列变化不能用勒夏特列原理解释的是
| A.向H2S水溶液中加入NaOH有利于S2-增多 |
| B.H2、I2、HI 混合气体加压后颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.新制氯水久置后颜色变浅 |
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
下列事实不能用勒夏特列原理来解释的是( )
| A.加压有利于SO2与O2反应生成SO3 |
| B.用过量氮气与氢气反应可以提高氢气的转化率 |
| C.将混合气中的氨气液化分离,有利于合成氨的反应 |
D.密闭容器中发生反应H2(g)+I2(g)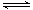 2HI (g),增大压强时容器中颜色加深 2HI (g),增大压强时容器中颜色加深 |